Rivaroxaban versus enoxaparine avec antagoniste de la vitamine K pour le traitement du thromboembolisme veineux symptomatique chez des patients atteints de cancer (EINSTEIN-DVT et EINSTEIN-PE) : analyse mutualisée de sous-groupes de deux essais randomi...
Publié le 29 septembre 2014 par Tartempion77
@NZarjevski
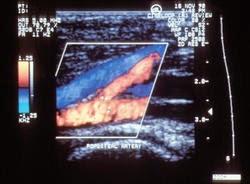
Echographie Doppler en couleur, artère et veine. Trajet de l'artère poplitée, en rouge, et de la veine, en bleu, en arrière du genou au niveau de la bifurcation de l'artère.
Source iconographique et légendaire: http://www.inserm.fr/thematiques/immunologie-hematologie-pneumologie/dossiers-d-information/thrombose-veineuse-phlebite
Les patients atteints de thromboembolisme veineux montrent un risque accru de tromboembolisme veineux et d’hémorragies au cours du traitement anticoagulant. Bien que la monothérapie à l’aide d’héparines de faible poids moléculaire soit recommandée chez ces patients ; dans la pratique clinique, beaucoup de patients atteints de thromboembolisme veineux et de cancer ne bénéficient pas de ce traitement. Notre but était d’étudier l’efficacité et l’innocuité d’un protocole prévoyant un médicament unique, le rivaroxaban en comparaison d’un protocole prévoyant l’administration d’enoxaparine suivi d’antagonistes de la vitamine K, dans le sous-groupe de patients atteints de cancer recruté dans les essais randomisés contrôlés EINSTEIN-DVT et EINSTEIN-PE.Nous avons une analyse de sous-groupes de patients souffrant de cancer (soit à l’inclusion, soit diagnostiqué au cours de l’étude), avec historique de cancer, ou n’ayant jamais présenté de cancer, ayant été recrutés pour les essais EINSTEIN-DVT et EINSTEIN-PE. Les patients éligibles, atteints de thrombose veineuse profonde (EINSTEIN-DVT) ou d’embolisme pulmonaire (EINSTEIN-PE), ont été répartis de manière aléatoire sous ratio 1:1 pour recevoir rivaroxaban (administration de 15 mg deux fois par jour pendant 21 jours, suivi par l’administration de 20 mg une fois par jour) ou la thérapie standard (enoxaparine 1.0 mg/kg deux fois par jour et warfarine ou acenocoumarol ; ratio international normalisé 2.0 – 3.0). La randomisation -effectuée à l’aide d’un système informatique à réponse vocale interactive- était stratifiée selon le pays et la durée de traitement prévue. (3, 6, ou 12 mois). Les résultats primaires d’efficacité et d’innocuité sur le plan clinique de ces deux essais, ainsi que l’analyse complémentaire, concernaient le thromboembolisme veineux récurrent symptomatique et l’analyse des hémorragies cliniquement significatives relevés, respectivement. Nous avons effectué les analyses d’efficacité et de mortalité sur la population en intention de traiter, et les analyses relatives aux hémorragies en fonction de la période de traitement déjà écoulée + 2 jours sur la population soumise à évaluation de l’innocuité (c.à.d tous les patients ayant reçu au moins une dose du médicament à l’étude).Chez tous les patients atteints de cancer (diagnostiqués à l’inclusion ou pendant le traitement), le thromboembolisme veineux récurrent est survenu chez 16 (5%) patients sur les 354 patients recevant le rivaroxaban et 20 (7%) patients sur les 301 patients recevant l’enoxaparine et l’antagoniste de la vitamine K (hazard ratio [HR] 0.67, Intervalle de Confiance [IC] 95% de 0.35 à 1.30). Les hémorragies cliniquement significatives sont survenues chez 48 (14%) des 353 patients recevant le rivaroxaban et chez 49 (16%) des 298 patients recevant la thérapie standard (HR 0.80, IC 95% de 0.54 à 1.20). Des hémorragies majeures sont survenues chez huit (2%) des 353 patients recevant le rivaroxaban et chez 15 (5%) des patients recevant une thérapie standard (HR 0.42, IC 95% de 0.18 à 0.99). La fréquence globale des thromboembolismes veineux récurrents chez des patients avec historique de cancer seul (cinq [2%] sur 233 patients dans le groupe rivaroxaban versuscinq [2%] sur 236 patients du groupe thérapie standard ; HR 0.98, IC 95% 0.28-3.43) était similaire à celle des patients n’ayant jamais présenté de cancer (65 [2%] sur 3563 versus 70 [2%] sur 3594, respectivement ; HR 0.93, IC 95% 0.66-1.30) ; ladite fréquence était augmentée chez les patients souffrant de cancer à l’inclusion (six [2%] sur 258 versus huit [4%] sur 204, respectivement ; HR 0.62, IC 95% 0.21-1.79), elle l’était encore plus chez les patients dont le diagnostic de cancer était établi au cours de l’étude (dix [10%] sur 96 versus 12 [12%] sur 97, respectivement ; HR 0.80, IC 95% 0.34-1.88). La fréquence globale des hémorragies majeures chez des patients avec uniquement un historique de cancer (un [<1%] patient dans le groupe rivaroxaban versus quatre [2%] patients dans le groupe thérapie standard ; HR 0.23, IC 95% 0.03-2.06) était similaire à celle des patients n’ayant jamais présenté de cancer (31 [1%] versus 53 [1%], respectivement ; HR 0.58, IC 95% 0.37 – 0.91) ; elle était augmentée chez les patients atteints de cancer à l’inclusion (cinq [2%] versushuit [4%], respectivement ; HR 0.47, IC 95% 0.15-1.45), et la plus élevée chez les patients diagnostiqués avec un cancer au cours de l’étude (trois [3%] versus sept [7%], respectivement ; HR 0.33, IC 95% 0.08-1.31).Chez les patients atteints de cancer et de thromboembolisme veineux, le rivaroxaban a présenté une efficacité similaire dans la prévention du thromboembolisme veineux récurrent et a réduit le nombre d’hémorragies majeures en comparaison du traitement à l’enoxaparine et l’antagoniste de la vitamine K, bien qu’aucune différence intergroupe n’ait été notée pour ce qui est des hémorragies cliniquement significatives. Sur la base de ces résultats, une comparaison directe de rivaroxaban avec les héparines de faible poids moléculaire administrées sur le long terme est recommandée chez les patients atteints de cancer. Prof Martin H Prins et al MD et al, dans The Lancet Haematology, publication en ligne en avant – première, 28 septembre 2014Financement: Bayer HealthCare Pharmaceuticals et Janssen Research & DevelopmentSource: The Lancet Online / Traduction et adaptation: NZ

