
est un physicien Danois qui a eu le prix Nobel de physique en 1922, pour ses travaux sur la structure de l'atome et de ses radiations. Et en effet, lorsqu'il a eu son Nobel la brasserie Carlsberg lui a offert une maison directement reliée à son usine de production de bière par un pipeline. Si si, la tireuse perso directement reliée à l'usine :).
Il est né en 1885 à Copenhague, au Danemark, et il est le père de la mécanique quantique. Carlsberg ne s'est d'ailleurs pas contenté de lui offrir une maison, très impliquée dans la recherche, la brasserie a aussi en partie financé son institut.
Le concept d'atome - les pionniers
Mais revenons un peu en arrière. La notion même d' "atome " est assez ancienne, on l'attribue souvent au philosophe Grec Démocrite (né en 460 avant J.-C.), bien qu'on suppose aujourd'hui que son maître à penser Leucippe (dont il fût le disciple) en soit le réel fondateur... bon, même là nous ne sommes pas sûr... un certain Mochos, Phénicien est parfois cité bref... c'est relativement ancien et peu documenté, les historiens ont encore du pain sur la planche.
L'idée à l'époque est plus philosophique que " physique " à proprement parler. Le courant de pensée atomiste pense que l'univers est constitué de matière et de vide, et que la matière est discontinue, composée d'éléments ou de briques élémentaires. Élémentaire veut dire qu'on ne peut plus décomposer en briques plus petites. Ces briques seront appelées les atomes (du Grec " ά-τομος ", " a-tomos " qui en français donnera " atome ". Atomos en Grec veut dire " insécable ", " in-coupable ", bref, la brique élémentaire qu'on ne peut plus subdiviser en sous éléments).
Nous découvrirons plus tard qu'en réalité ce que nous appelons aujourd'hui " atome " est lui-même constitué de sous particules plus petites. Ceci-dit c'est plutôt nous qui les avons mal nommés, parce qu'il existe bien des briques élémentaires qui composent les atomes, on a juste appelé " atome " une brique trop grosse, non élémentaire et constituée d'autres sous-briques.
Les premières mises en évidence
Il faudra quand même attendre le 18ème siècle pour que le chimiste français Lavoisier, qui n'est pourtant pas un atomiste convaincu, les mette (les atomes) en évidence lors d'une expérience, et fasse passer la chimie tout entière de l'alchimie à la chimie moderne.
Ceci-dit c'est ensuite le britannique John Dalton qui, de l'expérience de Lavoisier, théorisera les atomes " à la Démocrite ", par déduction des phénomènes observés (mais sans preuve). Il les décrira à nouveau comme des particules insécables. Brillant Dalton, mais sa théorie sera dans un premier temps assez mal accepté par la communauté scientifique.
La vision contemporaine de l'atome
Jusqu'à-ce que Lord Ernest Rutherford, Nobel de physique en 1908, observe qu'en bombardant une feuille d'or avec des particules eh bien... la majorité des particules traversent la feuille d'or sans être déviées, alors quelques unes changent carrément de direction, voire, repartent en arrière ?!? wtf ?
Hum hum se dit il... pour que tant de particules traversent sans souci, c'est que la matière est surtout constituée de vide !
- Les particules qui rebondissent doivent heurter un îlot de matière.
- Les particules qui sont déviées doivent être repoussées par une force électromagnétique. Or, comme j'ai bombardé de particules chargées positivement, l'îlot en question, qui les dévie, doit lui aussi être chargé positivement pour repousser mes particules.
L'îlot de matière en question est sans doute le noyau de l'atome !
De plus pour que ma feuille d'or soit neutre électriquement, comme ce noyau est chargé positivement, il doit y avoir des particules chargées négativement pour " équilibrer " les charges. Et ces particules doivent être petites et légères, vu qu'elles ne dévient rien du tout... ce serait pas les électrons ça ? De là va naître son modèle de l'atome en forme de système solaire.
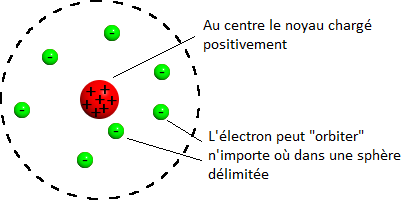
L'électron, chargé négativement, est attiré par le noyau chargé positivement, mais la force centrifuge liée à sa rotation le maintient à bonne distance, comme pour les planètes (attirées les unes vers les autres par la gravité). Sauf que... sauf que comme d'après les lois de l'électromagnétisme, un électron en rotation doit rayonner de l'énergie, et donc doit perdre cette énergie rayonnée, alors l'électron devrait ralentir et... s'écraser sur le noyau. Ce modèle donne un atome instable, peu compatible avec la vie et notre propre existence. Damned lord Rutherford !
L'électron ne doit pas pouvoir descendre en dessous d'une orbite minimale, alors là vas-y que Niel Bohr fait péter un nouveau modèle. Observant que les atomes n'émettent que certaines longueurs d'ondes bien précises quand on les excite (par exemple quand on les chauffe), il se dit que les électrons ne peuvent avoir que certains niveaux d'énergie, que certaines vitesses, que certaines trajectoires bien définies, correspondant au fait que finalement, ils n'émettent que certaines longueurs d'ondes bien précises (et toujours les mêmes pour un même élément). Cohérent quoi.
Les électrons dans son modèle ne peuvent " graviter " autours du noyau qu'a certains distances bien précises. Tout ces paramètres sont " quantifiés ", ils ne peuvent pas prendre n'importe quelle valeur. Puisqu'ils sont quantifiés, on appellera ça la mécanique " quantique ".
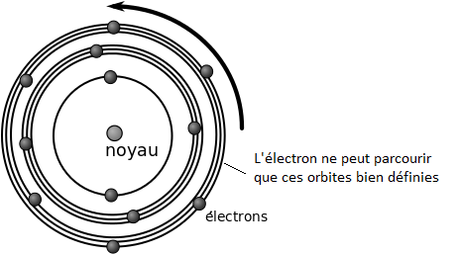
Le modèle atomique de Bohr
Sauf que... les équations mathématiques qui définissent la mécanique quantique arrivent à un résultat étonnant : il est impossible de connaître à la fois la position et la vitesse d'un électron - ce sont les équations qui le disent ! C'est le principe d'incertitude d'Heisenberg. Damed ! (again).
On ne peut donc pas vraiment parler de " trajectoire " pour les électrons, vu que quand on connait leur vitesse on ne sait pas où ils sont, et quand on sait où ils sont on ne peut pas connaitre leur vitesse... donc Bohr ok son modèle est pas mal, mais il définit des trajectoires, des sortes d'orbites bien définies qui ne collent pas avec les résultats des équations d'Heisenberg (petite précision, Heisenberg c'est l'élève de Niels Bohr en fait, Bohr en mécanique quantique ça reste le daron).
C'est là qu'intervient Schrödinger, un autre matheux de la bande (avec Heisenberg, ils arrivent aux mêmes conclusions avec des outils mathématiques différentes mais équivalents) qui propose un modèle dans lequel l'électron ne décrit pas une orbite mais plutôt : se trouve quelque part dans une zone définie, pas forcément ronde ou sphérique, autours du noyau.
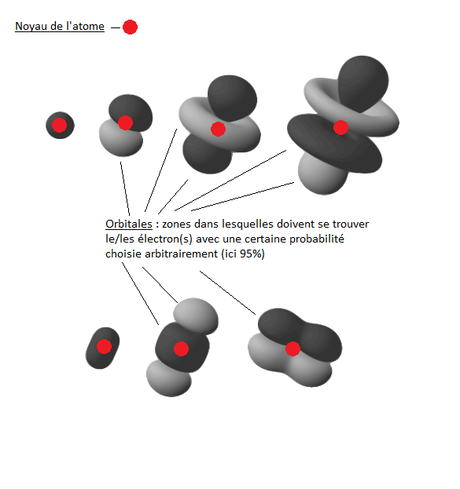
Cette zone on appellera ça une orbitale (oui mais on vient de dire que l'électron ne décrit pas une orbite, pourquoi appeler ça des orbitales ? Gnah gnah gnah c'est pas moi qui ait choisi le nom tu me cherches ou bien ?)
Le principe d'incertitude, l'indétermination tout ça... ça ne plait pas trop à Einstein (qui est contemporain de Bohr). Pour Einstein, les lois qui régissent l'univers ne peuvent pas être aussi " floues ", aussi indéterminées. Il utilise bien sûr lui aussi ces équations mais... pas de bon cœur.
Lors d'une dispute sur le sujet, Einstein dira à Niels Bohr que " Dieu ne joue pas aux dés ! ", sous entendu que " les lois de l'univers ne peuvent pas être floues ". Ce à quoi Niels Bohr répondra " Einstein, cessez de dire à Dieu ce qu'il doit faire ! ".

