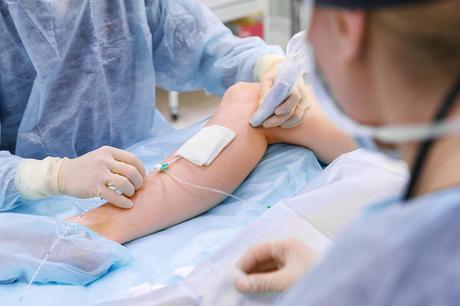
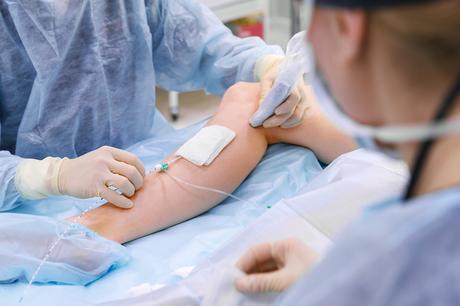
Les plaies chroniques aussi sont résistantes aux traitements antimicrobiens, cette nouvelle stratégie mise au point par ces microbiologistes et immunologistes de l’Université de Caroline du Nord (UNC) doit permettre d’améliorer considérablement l’administration et l’efficacité de ces médicaments en cas de plaies chroniques infectées.
Il s’agit d’un mode innovant d’administration de médicaments par ultrasons, ici appliqué aux plaies infectées avec biofilm et particulièrement aux plaies chroniques, des plaies ouvertes à retard de cicatrisation. Ces types de plaies sont extrêmement difficiles à traiter en raison d’infections bactériennes résistantes aux antibiotiques (dont à S. aureus résistant à la méthicilline ou SARM). Ces plaies infectées sont l’une des principales causes de décès par infection, chez les patients hospitalisés.
On sait aujourd’hui que les bactéries, pour mieux se défendre contre notre système immunitaire et mieux résister aux antimicrobiens se regroupent sous forme d’un film lisse et visqueux – ou biofilm -. Ce biofilm forme une barrière si épaisse que ni les cellules immunitaires ni les antibiotiques ne peuvent pénétrer et neutraliser les bactéries nocives.
L’étude : les chercheurs de Chapel Hill ont mis au point
une nouvelle méthode qui combine l’acide palmitoléique, la gentamicine et les ultrasons non invasifs,
afin d’améliorer l’administration de médicaments dans les plaies chroniques infectées par SARM. Ils montrent ici, sur des souris modèles de plaies diabétiques, que :
- cette nouvelle stratégie permet de réduire de 94 % l’infection dans les plaies ;
- il devient possible de stériliser totalement les plaies chez de nombreuses souris ;
- chez les autres modèles, la charge bactérienne est considérablement réduite.
Éviter le pire : lorsque les bactéries ne sont pas totalement éliminées des plaies chroniques, le risque de récidive de l’infection ou de développement d’une infection secondaire reste extrêmement élevé », explique l’un des auteurs principaux, le Dr Sarah Rowe-Conlon, professeur agrégé au Département de microbiologie et Immunologie de l’UNC. « Cette stratégie thérapeutique a la capacité d’améliorer les résultats et de réduire les rechutes d’infections des plaies chroniques chez les patients ».
Toujours lutter contre le biofilm : lorsque les cellules bactériennes sont consolidées à l’intérieur du biofilm, elles n’ont qu’un accès limité aux nutriments et à l’oxygène. Pour conserver leurs ressources et leur énergie, elles se plongent dans un état de dormance. Ces bactéries, connues sous le nom de cellules persistantes, sont alors extrêmement résistantes aux antibiotiques.
Les biofilms qui agissent comme une barrière physique et bloquent ainsi l’effet de nombreuses classes d’antibiotiques sont ici « désarçonnés » et agités par les ultrasons non invasifs qui finissent par créer des ouvertures dans le biofilm ce qui permet l’administration de médicaments sur le lit de la plaie.
Des gouttelettes de liquide activables par ultrasons, appelées agent de contraste à changement de phase sont appliquées localement sur la plaie. Un transducteur à ultrasons est centré sur la plaie et mis en marche, provoquant l’expansion du liquide à partir des gouttelettes. L’oscillation de ces microbulles agite le biofilm, le perturbant mécaniquement et permettant une augmentation de la délivrance de fluide. En fin de compte, c’est la combinaison de la perturbation du biofilm et de la perméation accrue des médicaments à travers le biofilm qui permet une meilleure délivrance du traitement en dépit du biofilm bactérien.
L’implication est considérable dans le soin de plaies, mais également au-delà, dans l’administration locale de médicaments chimiothérapeutiques aux tumeurs tenaces, ou encore pour l’introduction d’immunothérapies dans des cellules ciblées endommagées. Les chercheurs ont déjà opté pour la gentamicine, un antibiotique topique généralement inefficace contre S. aureus en raison d’une résistance généralisée aux antibiotiques et d’une faible activité contre les cellules persistantes. Mais ils ont ajouté un nouvel adjuvant antibiotique, l’acide palmitoléique, un acide gras insaturé, aux fortes propriétés antibactériennes. L’acide gras s’incruste dans la membrane des cellules bactériennes et facilite un peu plus l’entrée de l’antibiotique dans les cellules de S. aureus, ce qui permet de tuer les cellules persistantes et d’inverser la résistance aux antibiotiques.
Cette nouvelle approche topique non invasive constitue un outil précieux pour lutter contre la résistance aux antibiotiques, atténuer les effets indésirables graves de la prise d’antibiotiques oraux et soulager à terme les patients porteurs de plaies chroniques infectées.
« Avec ce système, nous sommes en mesure de faire fonctionner les médicaments topiques et de les appliquer au site même de la plaie et de l’infection à des concentrations très élevées, sans les risques associés à l’administration systémique ».
Source: Cell Chemical Biology 2023 DOI: 10.1016/j.chembiol.2023.04.009 Overcoming biological barriers to improve treatment of a Staphylococcus aureus wound infection
Plus sur le Biofilm
Équipe de rédaction SantélogNov 3, 2023Équipe de rédaction Santélog
