« La première fois que l'on étudie la thermodynamique, on ne comprend rien. La deuxième fois, on pense avoir compris. Et la troisième fois, on est sûr et certain de n'avoir finalement rien compris mais ce n'est pas grave car on arrive tout de même à l'utiliser et ça marche !»
La thermodynamique est une discipline majeure de la physique et a connue de nombreuses évolutions au cours des siècles. Elle a pour fonction première l'étude de la chaleur et des différentes machines thermiques mais elle a aussi comme mission l'étude des systèmes à l'équilibre. La thermodynamique a été élaborée principalement au 19ième siècle par des scientifiques de renom avec entre autre Carnot, Clapeyron, Lord Kelvin, Clausius, Boltzmann, Van der Waals etc. (voir portraits ci-dessus, vous remarquerez l'importance de la barbe).
C'est un sujet vaste et complexe, mon billet de blog qui arbore le titre « La thermodynamique » est bien ambitieux mais je vais essayer autant que possible de vous en donner un aperçu concis et le plus juste possible, ce qui n'est pas une tache évidente...
La notion de système
La thermodynamique étudie des systèmes. Un système est une portion de l'Univers que l'on isole par la pensée et tout se qui est hors de ce système est appelé milieu extérieur. Il existe trois types de systèmes :
- Les systèmes ouverts qui échangent de la matière et de l'énergie avec le milieu extérieur. Ex : une bouteille plastique d'eau ouverte : elle peut se remplir ou se vider, elle échange de la chaleur avec l'air ambiant et elle est déformable.
- Les systèmes fermés qui n'échangent pas de matière avec le milieu extérieur mais qui peuvent échanger de l'énergie sous forme de travail mécanique et de chaleur. Ex : une bouteille plastique d'eau fermée. Elle peut être déformée et elle échange de la chaleur avec l'extérieur mais la quantité de matière à l'intérieur ne change pas.
- Les systèmes isolés où il n'y a aucun échange avec le milieu extérieur (ni matière, ni énergie). Ex : une bouteille thermos fermée idéale rigide.

Les variables d'état
Différentes grandeurs (ou variables) physiques sont utilisées en thermodynamique. Il est primordial de bien les comprendre et de pouvoir les classer dans différentes catégories pour ensuite les utiliser.
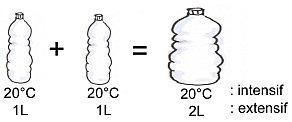
Tout d'abord, il faut distinguer les grandeurs extensives et intensives :
- Une grandeur extensive est une grandeur physique qui est proportionnelle à la taille du système (on peut les additionner). Ex : masse, volume, quantité de matière, etc.
- Une grandeur intensive est une grandeur physique qui ne dépend pas de la quantité de matière considérée (on ne peut pas les additionner). Ex : température, pression, densité, etc.
La thermodynamique cherche à calculer les grandeurs physiques d'un système à un état d'équilibre en fonction d'autres grandeurs. Pour cela, on définit des variables d'état qui sont des grandeurs physiques mesurables permettant de définir l'état d'un système, indépendamment du chemin suivit pour arriver à cet état.
Explication : Il y a quelques semaines j'ai fait une sortie en ski de randonnée dans les alpes suisses et nous devions atteindre le Mont Tellier situé à 2951 m en partant d'un parking situé à 1925 m. Deux groupes sont partis du parking par deux itinéraires différents :
- Le premier groupe a fait une ascension directe régulière totalisant 2951-1925 = 1026 m de dénivelé positif (trajet bleu).
- Le deuxième groupe a emprunté un chemin plus long nécessitant des montés et des descentes. Cet itinéraire totalisait 1500 m de dénivelé positif (trajet rouge).

Dans cet exemple, on peut définir l'état du système par la variable « altitude » car la différence d'altitude entre le parking et le sommet des 2 itinéraires est la même : DA = 2951-1925 = 1026 m : l'altitude est donc une variable d'état.
En revanche, l'effort mécanique fourni par le groupe rouge est nettement supérieur à l'effort mécanique fourni par le groupe bleu : la variable « effort mécanique » n'est donc pas une variable d'état car elle dépend du chemin suivit entre 2 états à l'équilibre.
En thermodynamique, les grandeurs d'état principales sont les suivantes :
- La température (T) qui se mesure en degré kelvin, voir billet La Température pour plus de précision.
- La pression (P) qui est une force par unité d'aire. La pression se mesure en pascal (1 Pa = 1 N/m²) mais on utilise souvent le bar par commodité (1 bar = 100 000 Pa). Un pneumatique de voiture gonflé à 2 bars signifie que l'air applique une force de 200 000 newton par mètre carré sur le pneu.
- Le volume (V) qui se mesure en mètre cube.
- L'énergie interne (U) qui représente l'ensemble des énergies microscopiques d'un système et se mesure en J/kg. L'énergie interne correspond à la somme des énergies dues à l'agitation thermique des particules et aux liaisons entre les nucléons, les atomes et les molécules.
- L'enthalpie (H) qui est une fonction pratique en génie thermique car lorsque qu'une transformation a lieu à pression constante, la variation de l'enthalpie exprime la quantité de chaleur échangée. L'enthalpie se mesure en J/kg et est définit par H = U+P*V.
- L'entropie (S) qui représente en quelque sorte le « désordre microscopique» d'un système et se mesure en J/K. On reviendra un peu plus tard sur la notion d'entropie.
Les grandeurs thermodynamiques qui ne SONT PAS des variables d'états (qui dépendent du chemin suivit) sont les suivantes :
- Le travail (W) qui se mesure en Watt et représente une énergie mécanique par seconde.
- La chaleur (Q) qui se mesure également en Watt et qui représente une énergie thermique par seconde.
Les fonctions d'état
Les différentes variables d'état ne sont pas indépendantes les unes des autres : elles sont liées de manière plus ou moins complexe et la thermodynamique a alors pour objectif de définir des « équations d'état » ou des « fonctions d'état » qui mettent en relations les différentes grandeurs d'état à l'équilibre.
La fonction d'état thermodynamique la plus simple et la connue est l'équation des gaz parfaits qui s'écrit :
P*V = n*R*T
où les grandeurs d'état sont la pression (P), le volume (V) et la température (T) avec « n » la quantité de matière et « R » la fameuse constante des gaz parfaits. Cette équation est un modèle fiable pour les gaz dit parfaits, c'est-à-dire les gaz constitués de particules suffisamment éloignées les unes des autres pour en négliger les interactions : le diazote et le dioxygène de notre atmosphère en sont un exemple.
Les transformations
On appelle transformation le passage d'un état d'équilibre initial à un état d'équilibre final. On identifie souvent les transformations par une variable d'état qui reste constante : une transformation à température constante (isotherme), à pression constante (isobare), à volume constant (isochore), à enthalpie constante (isenthalpique), à entropie constante (isentropique).
On entend également souvent parler de transformation adiabatique, cela signifie simplement que c'est une transformation au cours de laquelle le système n'échange pas de chaleur avec le milieu extérieur.
Plus généralement, il existe deux grandes classes de transformations :
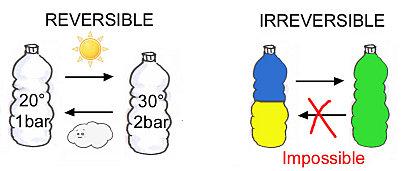
- Les transformations réversibles : une fois la transformation effectuée, l'état initial peut être rejoint depuis l'état final en appliquant une action mineure sur le système. Ex : Une bouteille d'eau fermée à température et pression ambiante (20°C, 1 bar) est laissée sous un soleil de plomb. La température monte alors à 30°C et la pression à 2 bar. Si le soleil disparaît sous un nuage, la bouteille retrouve son état initial au bout d'un certain temps.
- Les transformations irréversibles : une fois la transformation réalisée, il est impossible de revenir à l'état initial depuis l'état final de manière rapide et simple. Ex : Une bouteille est remplie de 2 liquides de mêmes densités et de couleurs différentes (un bleu et un jaune) séparés par une paroi étanche. On retire la paroi et les 2 liquides se mélangent. Il est alors impossible de retrouver l'état initial simplement.
Une transformation est généralement considérée réversible si les grandeurs intensives sont continues, si la transformation est lente (on dit alors qu'elle est quasi-statique) et s'il n'y a pas de phénomènes dissipatifs (diffusion, frictions, etc.).
On peut également retenir qu'une transformation adiabatique (qui n'échange pas de chaleur avec le milieu extérieur) et réversible est une transformation isentropique.
Bientot la suite qui expliquera les principes de la thermodynamique avec une introductions aux machines thermiques.
par Benjamin Bradu publié dans : Science/Philo/Religionajouter un commentaire 0 commentaire (0) commentaires (0) créer un trackback recommander Précédent : Les Probabilités et le Loto Retour à l'accueil
