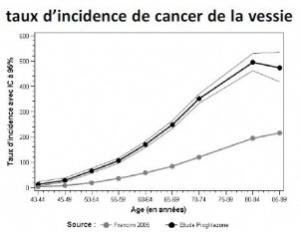
La Commission européenne vient de délivrer, à nouveau, au 13 octobre, une AMM valable dans toute l'Union européenne, pour Actos® du laboratoire Takeda. Une décision entérinée par l'Agence européenne du médicament. Or depuis juin dernier, la France a suspendu l'AMM de l'antidiabétique, en raison d'une faible augmentation du risque de cancer de la vessie chez les patients traités par pioglitazone. Trop de précautions face à trop d'affaires ? La France en a-t-elle trop fait ?Mais la conséquence, c'est que le laboratoire pourrait décider de remettre son produit sur le marché. A ses risques et périls.
Si le 9 juin dernier, sur avis de la Commission d'Autorisation de Mise sur le Marché (AMM) et de la Commission Nationale de Pharmacovigilance, l'Agence française du médicament avait décidé de suspendre les 2 antidiabétiques (à base de pioglitazone), le 21 juillet dernier, l'Agence européenne et son Comité des médicaments à usage humain (CHMP) décidaient déjà de maintenir Actos® (et le Competact) comme option thérapeutique valable, mais seulement pour certains patients diabétiques de type 2, sans aucun facteur de risque initial de cancer de la vessie et sous condition d'une réévaluation du rapport bénéfice-risque chez chaque patient, tous les 3 à 6 mois.
L'Europe : Le dernier rapport européen public d'évaluation (EPAR) pour Actos explique comment le comité des médicaments à usage humain (CHMP) a évalué le médicament et a opté pour un avis favorable à l'octroi d'une autorisation de commercialisation. Des données sur plus de 7.000 patients ayant reçu Actos montrent une diminution du taux de HbA1c, indiquant que les niveaux de glucose dans le sang ont bien été réduits avec des doses de 15 mg, 30 et 45 mg. Pour le CHMP, Actos s'est donc bien avéré aussi efficace que la metformine et le gliclazide. Néanmoins, l'Agence européenne s'est engagée à la publication de nouvelles recommandations.
Source: EMA « European public assessment report (EPAR) for Actos”


