 Après son approbation par l'Agence américaine FDA en septembre dernier pour la même indication, Soliris® (éculizumab) vient d'être approuvé pour les patients souffrant du SHUa, une maladie extrêmement rare et potentiellement mortelle. C'est donc le premier et seul traitement approuvé à la fois en Europe et aux Etats-Unis pour cette maladie. Pour découvrir le processus de la maladie (cliquer sur la vidéo ci-contre).
Après son approbation par l'Agence américaine FDA en septembre dernier pour la même indication, Soliris® (éculizumab) vient d'être approuvé pour les patients souffrant du SHUa, une maladie extrêmement rare et potentiellement mortelle. C'est donc le premier et seul traitement approuvé à la fois en Europe et aux Etats-Unis pour cette maladie. Pour découvrir le processus de la maladie (cliquer sur la vidéo ci-contre).
Soliris® (éculizumab) est le premier et seul traitement approuvé pour les enfants et les adultes souffrant du SHUa, une maladie génétique extrêmement rare et potentiellement mortelle. C'est une autorisation importante car Soliris, déjà approuvé pour une autre maladie rare, apporte aux enfants et aux adultes souffrant du SHUa un espoir de nature à transformer leur vie.
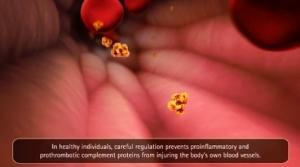
Le SHUa est une maladie génétique extrêmement rare, potentiellement mortelle, qui détruit progressivement les organes vitaux, ce qui peut entraîner un accident vasculaire cérébral, une cardiopathie, une insuffisance rénale ou le décès. La morbidité et la mortalité prématurée dans le cas du SHUa sont causées par une activation chronique incontrôlée du système du complément, aboutissant à la formation de caillots de sang dans les petits vaisseaux sanguins dans l'organisme, appelée micro-angiopathie thrombotique. Malgré des soins de soutien, plus de la moitié de tous les patients atteints de SHUa succombent, nécessitent une dialyse rénale ou présentent des lésions rénales permanentes dans l'année suivant le diagnostic. Soliris cible spécifiquement l'activation incontrôlée du complément.
Un cap majeur franchi pour les patients atteints du SHUa : Alexion Pharmaceuticals, le laboratoire fabricant a annoncé cette extension de l'indication thérapeutique du Soliris® (éculizumab) au traitement des patients pédiatriques et adultes souffrant du syndrome hémolytique et urémique atypique (SHUa). « Un cap majeur franchi pour les patients atteints du SHUa, dont l'activation incontrôlée du complément entraîne la défaillance progressive d'un organe et un large éventail de complications potentiellement mortelles» Car malgré des soins de soutien, plus de la moitié des patients atteints de SHUa nécessitent une dialyse rénale, présentent des lésions rénales permanentes dans l'année suivant le diagnostic et succombent à la maladie.
Un médicament pour la vie : « Il est recommandé de poursuivre le traitement par Soliris pendant toute la vie du patient, sauf si l'arrêt du Soliris est cliniquement justifié », explique la notice du produit. Son approbation pour le traitement du SHUa repose sur des données provenant de deux essais cliniques pivots ouverts prospectifs chez des patients adolescents et adultes atteints, ainsi que sur une troisième étude rétrospective réalisée chez des patients pédiatriques atteints.
Le remboursement du médicament doit encore être discuté entre Alexion et les autorités de santé des principaux pays européens.
Source: Communiqués BusinessWire, Alexion


