Tout ce qu'il faut savoir sur l'hémoglobine
résumé en 5 questions et moins de 700mots !
1 - Comment c’est fait ?
Alors c’est une protéine formée de 4 sous-unités (les globines), chacune correspondant à une suite d’acides aminés. Chez l’Homme adulte il y a deux types de sous unités différentes: 2 alpha et 2 bêta et au milieu de chacune de ces sous unités se trouve l’hème. Une sorte de petite pastille "magique" avec un atome de fer au centre qui donne sa couleur au sang (voir cet article pour plus de détails). D’où le nom « hemo-globine ».
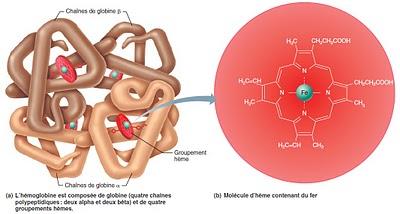
2 - Comment ça marche ?
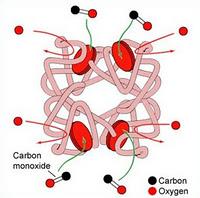 De façon basique, chaque hème peut fixer une molécule d’O2 donc au total 4 molécules d’O2 par molécule d’hémoglobine. Selon la quantité de dioxygène dans le milieu ces 4 molécules d’O2 peuvent se détacher ou se fixer sur l’hémoglobine. De façon accidentelle l’hème peut également fixer le CO (monoxyde de carbone) hyper-toxique ! (Ben oui il prend la place de l’O2 sur l’hème)
De façon basique, chaque hème peut fixer une molécule d’O2 donc au total 4 molécules d’O2 par molécule d’hémoglobine. Selon la quantité de dioxygène dans le milieu ces 4 molécules d’O2 peuvent se détacher ou se fixer sur l’hémoglobine. De façon accidentelle l’hème peut également fixer le CO (monoxyde de carbone) hyper-toxique ! (Ben oui il prend la place de l’O2 sur l’hème)
Mais ce n’est pas tout ! Le reste de la molécule peut aussi fixer du CO2, mais pas sur l’hème. Le CO2 se fixe sur le groupement NH2 de certains acides aminés formant des composés carbaminés. Du coup l’hémoglobine qui transporte l’O2 peut aussi transporter le CO2.
3 - A quoi ça sert ?
En fait l’O2 est très peu soluble dans l’eau et donc dans le sang. Du coup les animaux de grandes tailles doivent se débrouiller pour faire parvenir de grandes quantités d’O2 de leur appareil respiratoires vers leurs tissus. Ainsi 97% de l’O2 est transporté par l’hémoglobine chez l'Homme (seulement 3% sous forme dissoute contre 10% pour le CO2). L'hémoglobine peut circuler librement dans le sang chez certains animaux, ou être enfermée dans des cellules particulières: les érythrocytes ou globules rouges. Cette protéine n’est toutefois pas la seule solution au problème du transport de l’O2. Il existe pas mal d’autres molécules capables de fixer l’O2: l’hémocyanine des mollusques par exemple, comprend un atome de cuivre pour transporter l’O2 .
4 - Pourquoi ça marche si bien ?
L’hémoglobine est une petite merveille d’adaptation ! Plus il y a d’O2 dans le milieu plus l’hémoglobine fixe de dioxygène, mais cette relation n’est pas linéaire. La fixation d’une molécule d’O2 facilite la fixation de la seconde et ainsi de suite. On parle d’effet coopératif et l’hémoglobine de par cette propriété est qualifiée d’allostérique.
 C’est un peu comme détacher des timbres d’un carnet de quatre… Le premier est le plus difficile à séparer (il faut le déchirer sur 2 cotés), mais la séparation du 1er timbre vous facilite la tache pour le second (il n’y a plus qu’un coté à découper)… etc.
C’est un peu comme détacher des timbres d’un carnet de quatre… Le premier est le plus difficile à séparer (il faut le déchirer sur 2 cotés), mais la séparation du 1er timbre vous facilite la tache pour le second (il n’y a plus qu’un coté à découper)… etc.
5 - In Vivo, ça donne quoi ?
Lorsque le sang arrive dans les poumons, la quantité d’O2 disponible est grande. L’hémoglobine se charge très vite en O2 (un quart de seconde !) et jusqu’à une certaine altitude, il y a toujours assez d’O2 dans l’air pour saturer l’hémoglobine.
Une fois dans les tissus en fonctionnement, l’échange s’inverse et l’hémoglobine libère en moyenne 25% de son O2 en direction des tissus qui contiennent peu d’O2 vu qu’ils en consomment en permanence (ah bah bravo, c’est malin ! t’as encore consommé tout ton O2 !)
Dans le même temps une certaine partie du CO2 se fixe sur l’hémoglobine et sera ramenée vers les poumons pour être évacué. Le reste est transporté sous forme d’ions bicarbonates ou dissoute.
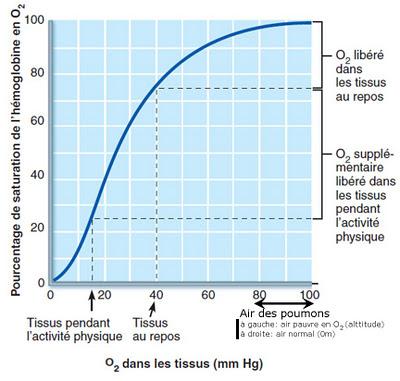 Les 75% d’O2 restant sur l’hémoglobine en temps normal sont une marge de manœuvre bien utile qui peut être exploitée sous certaines conditions :
Les 75% d’O2 restant sur l’hémoglobine en temps normal sont une marge de manœuvre bien utile qui peut être exploitée sous certaines conditions :- Peu d’O2 dans les tissus : Plus l’écart de concentration est élevé, plus l’échange est important.
- Beaucoup de CO2 dans les tissus : Ça tombe bien les tissus en fonctionnement en fabrique plein. Concrètement, l’hémoglobine lorsqu’elle fixe le CO2 change de forme et se débarrasse plus facilement de l’O2.
- Une température élevée : Là encore super pratique! L’air frais dans les poumons permet de fixer l’O2 et la chaleur des muscles de le libérer.
- Un pH acide : plus connu sous le nom d’effet Bohr, l’acidité liée à la présence de CO2 permet de libérer plus d’O2.
Conclusion :
L’hémoglobine grâce à sa structure, remplit évidemment parfaitement sa fonction de transporteur du dioxygène d’une part. Mais en plus de cela, elle transporte une partie du CO2 et permet, par ses propriétés, l’adaptation de l’organisme à une grande variété de situations écophysiologiques.
- Des questions ? -
[Retour à l'accueil]

