L'affaire des implants mammaires PIP relance aussi le débat politique aux Etats-Unis, sur le système d'évaluation américain des dispositifs de santé. Car la sécurité implique des délais d'approbation qui peuvent atteindre 2 années de « retard » par rapport à l'Europe. Le prix de la sécurité américaine coûte à l'économie, aux fabricants comme aux praticiens qui voudraient pouvoir disposer plus vite des innovations technologiques. Mais l'affaire des implants PIP, déclencheur d'une révision globale de la réglementation et du système d'évaluation européen des dispositifs de santé, est aussi un déclencheur pour les Etats-Unis. S'ils ont su préserver leur marché des prothèses défectueuses et garantir un certain niveau de sécurité, la pression est forte sur l'Agence américaine, la Food and Drug administration, pour raccourcir les délais d'approbation. Rapidité peut-elle rimer avec sécurité ? C'est ce que le Congrès américain devra trancher dès septembre prochain.
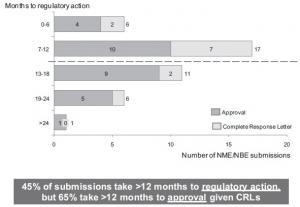
L'idée serait, pour l'Agence FDA de pouvoir garantir le même niveau de sécurité mais avec plus de rapidité. Mais l'affaire des implants PIP influence le débat actuel et constitue un contre-argument de poids à plus de rapidité. En septembre, le Congrès américain devra donc décider, avec le recul donné par cette affaire, des modifications éventuelles de la réglementation américaine qui, sur la rapidité, souhaitait se caler, avant cette affaire, sur la rapidité du modèle européen.
L'article publié dans le Lancet récemment a fait également grand bruit car il attribue l'entière responsabilité du scandale des implants PIP à l'incapacité des régulateurs européens à garantir la sécurité, et les institutions sanitaires en général, à corriger rapidement les défauts de leur système d'évaluation.
Source: Boston Consulting Group “ Competitiveness and regulation » The Lancet(Vignette), Volume 379, Issue 9811, Page 93, 14 January 2012 doi:10.1016/S0140-6736(12)60041-5 “Silicone breast implants: lessons from the USA”
 Accéderaux dernières actualités sur les implants
Accéderaux dernières actualités sur les implants


