Le bon sens veut qu’une réaction chimique se fasse, puis qu’on en entende plus parler. Scientifiquement, on dit que la réaction a atteint l’équilibre. Il n’en empêche que certaines réactions, dont la plus connue est celle de Belousov-Zhabotinsky sont oscillantes, c’est-à-dire que les concentrations en réactifs et produits… oscillent, bref varient du tout au tout en permanence. Lorsqu’un composé a une couleur, le changement perpétuel de couleur, dû au passage par un certain seuil de concentration, est assez inhabituel :
L’explication
La réaction peut continuer longtemps, très longtemps comme ça. L’explication du phénomène fait appel au modèle proie-prédateurs, généralement décrit par les équations de Lotka-Volterra. C’est très simple à comprendre : prenons des loups et des lapins, dans un même écosystème. Au fur et à mesure que les loups mangent les lapins, les loups restants n’ont plus rien à manger : ils meurent de faim. Du coup, le peu de lapins cachés dans leurs terriers peuvent prospérer à nouveau (se reproduire), jusqu’au stade où, assez nombreux, les loups restants retrouvent quelque chose à se mettre sous le dent, et ainsi de suite. Dans la nature, c’est ainsi qu’est instauré l’équilibre entre proies et prédateurs.
L’étude des systèmes chimiques oscillants n’est pas nouvelle, cependant ce n’est que récemment que l’on a pu les appréhender de manière satisfaisante :
En 1828, Fechner observe le changement périodique de l’aspect du fer plongé dans l’acide nitrique concentré : le métal est terne, puis brillant, puis terne de nouveau et ainsi de suite…
Schönbeim, en 1836, parle en ces termes : “un phénomène aussi étrange que celui-ci mérite assurément toute l’attention du chimiste”.
En 1834, Munck Af Rosenschöld constate que le phosphore émet des éclairs lumineux par intermittence avec une certaine régularité.
En 1874, Joubert montre que ce phénomène est dû à l’oxydation du phosphore par l’oxygène de l’air mais ne poursuit pas l’étude plus loin.
En 1896, Raphaël Liesegang en déposant une goutte de nitrate d’argent sur du bichromate de potassium dans la gélatine découvre qu’un précipité se dépose, sous formes d’anneaux concentriques appelés depuis anneaux de Liesegang.

Anneaux de Liesegang à Pénestin, en Bretagne. Ils sont dus à des réactions oscillantes au sein de la roche.
En 1906, Luther, en tentant de modéliser la propagation de l’influx nerveux au moyen d’une réaction dans un tube voit se développer des ondes chimiques.
En 1937, Arthur Arndt en étudiant l’agrégation des amibes s’aperçoit qu’elle se produit de manière désordonnée. Il observe plus précisément une agitation périodique sous forme d’un motif d’onde s’enroulant autour du centre d’agrégation.
Morphogènes
En 1952, Alan Turing, informaticien (et inventeur de l’ordinateur moderne), s’intéresse au phénomène : “On suggère qu’un système de substances chimiques, appelés morphogènes, réagissant entre elles et diffusant à travers un tissu peuvent expliquer le principal phénomène de la morphogenèse”, écrit-il. Cette notion de morphogène est à la base de la biologie du développement, étant donné le rôle capital dans l’embryogenèse des substances chimiques dont la concentration fluctue et affectant certains motifs.
Les morphogènes, substances chimiques participant à des réactions auto-catalytiques génératrices de formes, doivent diffuser plus lentement que les autres substances chimiques ; par conséquent il existe un couplage entre la formation rapide de ces espèces et leur lente diffusion. Ce couplage aboutit spontanément à la formation de pics périodiques de concentration. Ces pics de concentration sont extrêmement importants durant l’embryogenèse, car ils spécifient la spécialisation des cellules et le devenir des tissus : tel endroit de l’embryon deviendra un bras, tel autre une jambe, tel autre encore un œil.
On peut citer la protéine Sonic Hedgehog, dont les travaux valurent à leur auteurs le Prix Nobel de médecine 1995, mais qui n’est pas moins importante que BMP4 ou Wnt dans la morphogenèse.
Dans le cadre de l’embryogenèse y compris, la séparation périodique entre deux pics dépend uniquement du phénomène de diffusion, et le mécanisme proposé par Turing permet d’observer plusieurs phénomènes : structures stationnaires, oscillations, ondes chimiques.
Cybernétique et chimie
En fait, les réactions oscillantes relèvent de la cybernétique, c’est-à-dire qu’une rétroaction tend à modérer un comportement s’écartant d’une valeur de consigne. Cette tendance se retrouve cependant dans toutes les réactions : c’est la loi de modération des équilibres de le Chatelier (lorsqu’une réaction a lieu spontanément dans les deux sens, le fait d’ajouter des produits tend à déplacer la réaction dans le sens qui les consomment : l’accumulation est ainsi évitée, ce qui est très important en biochimie lorsqu’il s’agit de produits toxiques).
La cybernétique, via les rétroactions hormonales, est prépondérante dans les systèmes vivants : elle est à base de l’homéostasie, ou maintien d’un milieu intérieur stable. En plus de phénomènes davantage complexes, des réactions oscillantes assureraient qu’il reste toujours certains éléments au sein des cellules. En effet, beaucoup de réactions chimiques ont tendance à ne pas revenir en arrière spontanément, c’est-à-dire qu’à moins de fournir de l’énergie (chez les êtres vivants par l’hydrolyse de l’ATP) la consommation totale d’un réactif est irréversible. Si la cellule ne peut le produire pour satisfaire à ses besoins, elle dépérit donc, sauf à compter sur un retour en arrière d’une réaction chimique, d’autant plus efficace s’il y a oscillations. C’est ce qui ce passerait pour les tubulines, constituants des microtubules (charpente cellulaire). Ce phénomène est abondamment étudié, car le dérèglement de ces réactions oscillantes pourrait être à l’origine de certains cancers (voir ce lien : http://www.jle.com/fr/revues/medecine/hma/e-docs/00/02/23/32/article.phtml)
Systèmes dissipatifs
Avec les réactions oscillantes, les chimistes ont mis la main sur le pot-aux-roses. Elles sont en effet un domaine qui n’en finit pas de livrer des secrets. Quel est en effet le rapport entre les réactions oscillantes, les bananes, les girafes, les zèbres, ou encore les léopards ?
Il a été démontré que les tâches du guépard, et les zébrures sont dues à des systèmes dissipatifs oscillants, c’est-à-dire des systèmes opérant loin de l’équilibre thermodynamique et changeant sans cesse.

Le pelage de la girafe est orné de tâches régulières, et des poissons, de même que certaines variétés de bananes en ont : c’est ce qu’on appelle la convergence évolutive.
La réaction CIMA
En 1989, Vincent Castets étudie à Bordeaux la réaction CIMA (Chlorite-Iodure alcalin-acide MAlonique). Il observe dans le réacteur-gel des fronts stationnaires analogue à ceux observés dans l’écoulement de Couette. Il était nécessaire qu’une brisure de symétrie se produise pour pouvoir apercevoir les structures prévues par Turing. A cause de la présence persistante d’une bulle dans le réacteur, De Kepper décida de l’agiter vivement et à sa grande surprise, il vit apparaître pour la première fois les structures dites de Turing, qui ont une allure cristalline hexagonale.
Or l’acide malonique est un produit d’oxydation du jus de pomme et de certaines betteraves. Bien qu’il soit un poison pour nous, des propriétés chimiques aussi intéressantes (aptitude à l’organisation structurale) laissent à penser que ce genre de composés a pu avoir un rôle dans l’origine de la vie.
La réaction de Briggs-Rauscher
En 1917, à Berkeley, William C. Bray et son étudiant A. L. Caulkins observent lors de la rencontre en solution aqueuse du couple diiode-iodate (I2/IO3-) et de l’eau oxygénée H2O2 un dégagement d’oxygène irrégulier. Cependant le milieu scientifique de l’époque est dubitatif : on pensait alors que seul un milieu hétérogène pouvait être à l’origine de telles oscillations. Cette hésitation persista même après que Bray eut démontré que l’iodate était l’agent auto-catalytique !
En 1973, deux professeurs – de collège ! - Briggs et Rauscher, en cherchant un expérience de chimie amusante, eurent l’idée d’ajouter à la solution de l’amidon qui révèle la présence d’ions iodure I-. Le mécanisme de cette réaction a été démontré par Noyes. Son fonctionnement ressemble à celui de nombreuses autres réactions encore étudiées aujourd’hui, dont la réaction CIMA utilisée par l’équipe de De Kepper pour découvrir les structures de Turing.
La réaction de Belousov-Zhabotinsky
Parlons-en de cette fameuse réaction ! C’est la plus connue des réactions oscillantes. Il s’agit d’une réaction chimique dont le mécanisme n’est pas linéaire (comprendre par là que les composés entrent un interaction dans tous les sens) et qui peut être décomposée en une quarantaine d’actes élémentaires (c’est beaucoup !) Elle fut découverte par un biologiste russe du nom de Belousov qui étudiait le cycle de Krebs. Le cycle de Krebs est un mécanisme biochimique complexe à intervenant dans les mitochondries, et à l’origine de la production d’énergie sous forme d’ATP (adénosine triphosphate). Belousov cherche à comprendre le rôle (primordial) de l’acide citrique, qui est oxydé dans ce cycle. Il pense le doser grâce au bromate de potassium KBrO3 mais la réaction est trop lente. Il ajoute donc du Ce4+ pour la catalyser, et constate alors que le milieu réactionnel change de couleur périodiquement. Il entreprend bien sûr une étude approfondie en faisant varier le pH de la solution et en ajoutant de la ferroïne (indicateur coloré d’oxydo-réduction à base de Fe2+). Cependant, toute ses publications sont refusées par des jurys hostiles à l’idée d’oscillations chimiques. Avant d’abandonner ses recherches, il publie toutefois une note dans un journal méconnu (Sbornik Referatov po Radiaconi Medecine), mais étant donné la guerre froide, pas grand monde à l’Ouest n’a vent de ses découvertes.
En 1961, un jeune biophysicien, A. Zhabotinsky, s’intéresse aux phénomènes oscillants dans les milieux biologiques. Il contacte alors Belousov qui lui indique les références de sa publication. En quelques mois, Zhabotinsky réussit à obtenir des oscillations et à montrer que l’acide citrique peut être substitué par l’acide malonique : c’est pourquoi il s’agit d’un poison. Il publie ses résultats dans Biophysika en 1962.
Voici la description de cette réaction, telle qu’on la trouve sur Internet :
Première phase :
Br- + BrO3- + 2 H+ -> HBrO2 + HOBr
Br- + HBrO2 + H+ -> 2 HOBr
Br- + HOBr + H+ -> Br2 + H2O
Br2 + HOOCCH2COOH -> HOOCCHBrCOOH + Br- + H+
L’acide bromique HBrO2 réagit avec une grande quantité de Br- (la concentration en Br- diminue). Ceci entraine la bromation de l’acide malonique (dernière étape)
Deuxième phase :
BrO3- + HBrO2 + H+ -> 2 Br O2 + H2O
BrO2 + Fe2+ + H+ -> Fe3+ + HBrO2
2 HBrO2 -> HOBr + BrO3- + H+
Du fait de la baisse de concentration en ions bromure Br-, l’acide bromique ne peut plus réagir comme auparavant. Il forme donc, en se combinant avec le bromate BrO3-, le radical BrO2 qui permet l’oxydation des ions Fe2+ en Fe3+
Troisième phase :
2 Fe3+ + HOOCCHBrCOOH + HOOCCH2COOH + 3 H2O -> 2 Br- + 2 Fe2+ + 3 HOOCCHOHCOOH + 4 H+
Quand la concentration en Fe3+ commence à devenir importante, Fe3+ est alors réduit en Fe2+ avec production d’ions bromures Br-. L’augmentation de leur concentration stoppe alors la progression de la deuxième phase en favorisant la première. Les ions bromure Br- permettent alors d’initier un nouveau cycle.
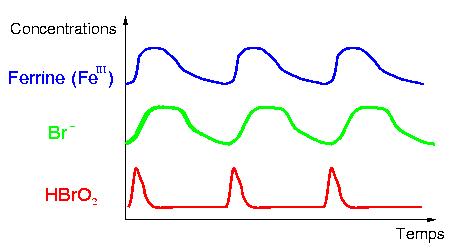
Profil d’évolution des espèces : les vaguelettes sont typiques des réactions oscillantes.
Motifs chimiques
L’étude des réactions oscillantes est passionnante, dans la mesure où certaines réactions oscillantes génèrent des motifs. Les chercheurs notent une tendance à l’auto-organisation des systèmes dissipatifs, tels les cellules de Bénard, turbulences induites par la convection (cela ressemble à ce qu’il se passe quand on porte de l’eau à ébullition). Le dépôt de colorants, et de capteurs, dans de l’eau portée à ébullition montre que le phénomène comporte une part de hasard, mais reste pour autant prévisible : il est chaotique (c’est-à-dire relevant de la théorie du chaos), mais des attracteurs, graphes utilisés dans l’étude des systèmes dynamiques, peuvent modéliser son comportement.
Un document Powerpoint consacré à la génèse de rythmes et de formes par les réactions chimiques est à lire ici : www.labos.upmc.fr/lcmcp/files/livage/…/P.%20De%20Kepper.ppt
Il a aussi été montré qu’à partir d’un écoulement de Couette, c’est-à-dire un liquide compris entre deux cylindres tournant à deux vitesses différentes, l’introduction du mélange réactionnel de Belousov-Zhabotinsky provoque l’apparition de bandes parallèles de concentration homogène dues au couplage entre les réactions chimiques et les phénomènes de diffusion.
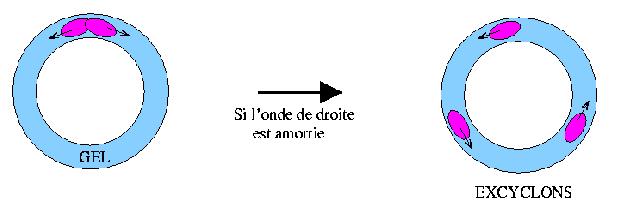
Récemment, le centre de recherche Paul Pascal à Bordeaux a étudié la propagation des ondes chimiques dans un anneau de gel. A l’aide d’une impulsion lumineuse, les chercheurs ont déclenché la réaction en un point de l’anneau, ce qui générait deux ondes chimiques se propageant en sens contraire et qui s’annihilaient après un demi tour. Cependant s’il advenait que l’une des deux soit amortie, l’autre pouvait continuer et parcourir ainsi plusieurs tours. On a même pu observer des trains de douzes ondes de ce type. Ces ondes ont été nommées excyclons. Cliquer ici pour en savoir plus (en anglais).
Diminution de l’entropie ?
L’observation de motifs chimiques peut sembler contre-intuitive : a-t-on déjà vu un morceau de sucre dissous dans une tasse se reformer ou bien s’agréger sous forme de motifs particuliers ? Non ! Car l’entropie, fonction d’état thermodynamique assimilable au désordre, augmente.
Le second principe de la thermodynamique impose que l’entropie totale d’un système isolé (n’échangeant ni matière ni énergie avec l’extérieur) croisse au cours du temps. La création de motifs chimiques générant un certain ordre, on a tendance à penser que les réactions qui les produisent vont à l’encontre des lois de la thermodynamique. Il n’en est rien…
Toute diminution de l’entropie due aux oscillations périodiques ou à la création de formes est largement compensée par l’entropie crée par les autres réactions. De plus, l’auto-organisation du système, se traduisant par la création de formes, provoque une diminution importante de l’entropie qui peut être compensée par la dissipation d’entropie vers le milieu extérieur, si bien que l’entropie finale du système soit plus grande que l’entropie initiale. L’entropie étant liée à la chaleur, pour peu que le système ne soit pas isolé, une augmentation de chaleur est corrélée à une augmentation de l’entropie.
Du second principe, il découle également que l’enthalpie libre doit décroître lors de l’évolution spontanée d’un système chimique. Les études montrent que dans une réaction oscillante, l’enthalpie libre, partant d’un maximum, décroît relativement linéairement ; ce sont les concentrations qui fluctuent de manière sinusoïdale. Du fait de la baisse de l’enthalpie libre, jusqu’à devenir nulle, les réactions oscillantes finissent donc pas s’arrêter. Elles comportent également un équilibre, mais tout dépend de la cinétique réactionnelle : cela peut durer quelques secondes, comme des mois !
Le Bruxellateur
En 1967, à Bruxelles, R. Lefever en compagnie de I. Prigogine et G. Nicolis, après avoir étudié le modèle de Lotka et constaté l’insuffisance du modèle de Turing qui aboutissait parfois à des concentrations d’espèces chimiques négatives, chercha un mécanisme plus simple pour obtenir des oscillations. L’étape la plus déterminante de ses recherches fut d’ajouter une étape trimoléculaire dans son mécanisme. C’est ainsi que fut créé le Bruxellateur :
A -> X (k1)
B + X -> Y + D (k2)
2 X + Y -> 3 X (k3)
réaction auto-catalytique
X -> E (k4)
Ce modèle permet de démontrer que certaines réactions chimiques peuvent être à l’origine d’une auto-organisation du système. De plus, il est possible d’apercevoir des ondes chimiques et grâce à ce modèle apparaît un cycle limite pour le système.
Pour en savoir plus, voir un dossier de concours étudiant la cinétique et le mécanisme précis d’une réaction oscillante : http://www.scei-concours.fr/tipe/sujet_2003/exemple%20sujet%20de%20chimie%202003.pdf
A voir également, une excellente vidéo de Canal-U (videothèque numérique de l’Enseignement Supérieur) sur la morphogenèse chimique : http://www.canal-u.tv/video/universite_de_tous_les_savoirs/morphogeneses_chimiques_les_reactions_creatrices_de_rythmes_et_de_formes.1089
Le Bruxellateur, vu par l’Université Pierre et Marie Curie (Paris) : http://www.lmm.jussieu.fr/~hoepffner/enseignement/stab_exam2009.pdf
Le document stipule : “Seuls les systèmes chimiques dont les réactions possèdent des mécanismes cinétiques présentant des boucles de rétroaction peuvent donner naissance à des phénomènes d’auto-organisation temporelle ou spatiale à condition qu’il soit assez loin de l’état d’équilibre. Le cas le plus simple de rétroaction est l’auto-catalyse, c’est-à-dire l’activation d’une réaction par l’un des produits qu’elle forme.” Or l’auto-catalyse est à la base du mécanisme biologique d’auto-épissage (maturation des ARN messagers par transestérification, conduisant à partir d’une même séquences d’ADN à différents transcrits), d’où la formidable utilité des réactions intégrant des rétro-actions : elles évoluent en fonction de leur environnement, et c’est une des caractéristiques majeures du vivant…
Un article de Pour la science évoque également le lien entre morphogènes imaginés par Turing (découverts depuis lors) et les tâches du léopard : http://www.pourlascience.fr/ewb_pages/a/actualite-quoi-servent-les-taches-du-leoparda-26019.php.
48.856667 2.350987