La chimie peut générer des choses étonnantes. C’est le cas d’un précipité connu sous le nom d’arbre de Diane :

Arbre de Diane
Il s’agit d’une végétation métallique d’argent (il en existe d’autres tel l’arbre de Mars, végétation de fer), dont le nom provient de l’alchimie, dans laquelle les personnages de la mythologie romaine étaient associés aux métaux, preuve que cette forme de science ancestrale suis a connu ses heures de gloire avec Nicolas Flamel n’est pas tout-à-fait morte…
Etrangement, la première mention des végétations date de 1660, par Athanase Kircher. On les percevait alors comme des arbres en raison de la texture dendritique :
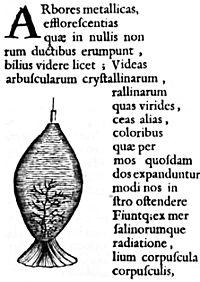
Extrait de l’ouvrage Mundus Subterraneus, cette page est la première de l’Histoire à mentionner les végétations.
Cette similitude remarquable avec les arbres provient du fait qu’il s’agit de dendrites fractales, dénomination elle-même due à la ressemblance avec les dendrites en biologie (prolongements arboriformes du corps cellulaire des neurones, maximisant ainsi la surface d’échange de l’information).
Les végétations rocheuses sont pourtant connues des alchimistes depuis le haut Moyen-Âge. En fait, on n’est pas sûr qu’ils connussent la recette, mais on sait que les alchimistes se refusaient à produire des formes d’arborisation, car cela leur semblait trop proche de la nature. Le fait que ces végétations croissent leur paraissait magique, et il les considérait comme vivantes.
Derrière ce mysticisme se cache pourtant une complexité mathématique prodigieuse, étant donné l’aspect fractal (homothétie interne tridimensionnelle, ou structure similaire à de nombreuses échelles) de ce phénomène. L’alchimiste Crosset de l’Haumière (pseudonyme de Francisco Maria Pompeo Colonna), l’un des rejetons de la famille princière italienne, installé en France décrit une expérience de végétation métallique – d’autant qu’à l’époque on ne lésinait pas sur les moyens mais utilisait l’or :
“Certainement, il n’y a rien de plus beau ni de si brillant que cette tige d’or, avec diverses figures et feuillages éclatants ; car il semblait que la nature, pour relever l’art, se fit un plaisir de former tant de différents accidents… On y voyait, dit, des espèces de bois où il semblait qu’il y eut des sentiers : il y avait quelquefois sur les bords de ces bois des cavités entrecoupées comme par des racines d’arbres, semblables à celles que l’on voit autour de certaines montagnes …“
Alors que les constations de l’abbé Nollet sur la pression osmotique sont à l’état de germe, et qu’on n’invoque pas la capillarité, Antoine Lémery va jusqu’à voir en les métaux qui produisent les végétations le moyen dont la sève monte en haut des arbres !
Les végétations métalliques apparaissent surtout lors de réactions d’oxydoréduction. Elles sont faciles à produire, c’est pourquoi l’expérience se fait souvent en TP de chimie au lycée, et assez spectaculaires. Cela ressemble fort à des paillettes, et on n’ose imaginer quel serait le résultat avec de l’or !
La recette tient en une phrase : dans un bécher, déposer une spirale de cuivre (pour l’effet d’enroulement), et une solution de nitrate d’argent (incolore).
Le chimiste grec Rhodès Carasses est le premier à publier dans le Journal des savants en 1677. Il précise qu’Antoine Furetière, poète français et académicien, avait déjà été témoin de ce phénomène.
Au XVIIIème , les végétations vont se faire connaître. Si Athanase Kircher utilise du mercure à la place du cuivre, Léméry utilise de l’argent dissous dans de l’acide nitrique (qu’on appelait alors eau-forte) dilué. Par conséquent, la réaction est lente : elle prenait plus d’un mois ! Avec cette réaction ralentie cependant, Léméry obtient des arbres beaucoup plus beaux, car plus ramifiés, et dont les branches se terminent par des petites boules que les gens prennent pour les fruits de l’arbre.
En 1962, une observation d’importance est présentée devant l’Académie Royale des Sciences par le chimiste hollandais Guillaume Homberg. La méthode proposée permet de produire un arbrisseau en quelques minutes.
En 1731, Charles Marie de la Condamine réitère l’expérience avec un grand nombre de métaux en disposant un clou au centre de la solution.
Si le phénomène passionne les chimistes et certains curieux par sa fascinante beauté (il est évoqué par l’abbé de Vallemont, littérateur, au demeurant physicien), il reste une intrigue pour les scientifiques.
Explication moderne
Aujourd’hui, on sait que le cuivre réagit avec les ions argent selon l’équation :
Cu(s)+ 2 Ag+(aq) = 2 Ag(s)+ Cu2+(aq)
Etant donné la présence d’une phase solide au sein du liquide, on parle d’état polyphasique, aspect plus attirant encore que si l’arbre se formait à l’air libre.
Les couples en présence dans cette réaction sont Cu2+/Cu et Ag+/Ag.
Côté oxydation, le cuivre perd 2 électrons qui vont à l’argent ; il est réduit : Cu(s)=Cu2+(aq)+2 e-
Côté réduction, l’argent gagne 1 électron ; il est oxydé : Ag+(aq)+1 e-=Ag(s)
Ce va-et-vient d’électrons entre l’argent et le cuivre génère un courant électrique. La réaction de formation de l’arbre de Diane peut donc servir de pile ! Calculons son voltage théorique à 25° C :
Le potentiel standard du couple Cu2+/Cu est de 0.1590 V, celui du couple Ag+/Ag est de 0,7996 V. Mettons que la solution contienne une mole de nitrate d’argent ; d’après l’équation de Nernst :
- pour le cuivre, E=E°cuivre-0.059/2*ln(1/1)=0.1590
- pour l’argent, E=E°argent-0.059/1*ln(1/1)=0.7996
La force électromotrice de la pile s’ensuit : elle vaut 0.7996-0.1590=0.6406 V. C’est déjà ça…

Arbre de Diane dans un erlenmeyer
Les ions nitrate NO3- ne participent pas à la réaction (ils sont dits spectateurs) ; en revanche on observe une coloration bleutée s’accentuant : celle-ci est due à la formation des ions cuivre II (Cu2+) hexahydratés (se complexant avec 6 molécules d’eau). En fait, il y a formation du complexe octaédrique (Cu(H2O)6)2+, dont la couleur s’explique par la théorie du champ cristallin. Pour la petite histoire, c’est la présence du cuivre à la place du fer qui donne au sang de limule sa couleur bleue (présence d’hémocyanine et non d’hémoglobine).
“Les cristaux de zinc irisés acquéraient par là un éclat métallique”.
En matière de végétations, Lavoisier, fondateur de la chimie moderne, a d’ailleurs essayé tous les métaux et semi-métaux (désignation désuette des pnictogènes, éléments chimiques aux propriétés métalloïdes) : on trouvera numérisé un de ses ouvrages où il décrit des mixtures de mercure, bismuth, zinc, antimoine… Lorsque je lis ses lignes sur l’utilisation de muriate (chlorure) d’antimoine, je me demande si aujourd’hui encore ses travaux sont égalés ! http://books.google.fr/books?ei=vNSyT7zVBurE0QWC2rXGCQ&hl=fr&id=YGwri-w7sMAC&dq=%22vegetations+metalliques%22+chimie+explication&ots=wk5uKl5Zfc&q=vegetation#v=onepage&q&f=false
Au passage, je salue Google et Gallica (BNF) qui reconstituent la bibliothèque d’Alexandrie en scannant le patrimoine culturel de l’humanité !
Pour les intéressées, on trouvera un mémoire de l’Académie Royale des Sciences daté de 1722, relatant une nouvelle espèce de végétations métalliques : http://ia600404.us.archive.org/15/items/histoiredelacad31laca/histoiredelacad31laca.pdf
Un ouvrage intitulé “Dictionnaire encyclopédique des amusemens [sans t !]des sciences mathématiques et physiques” daté de l’an de grâce MDCCXCIL (1839 !) est même consultable. Il fait bien sûr état des végétations : à voir (et télécharger, en plus c’est légal… !) ici : http://gallica.bnf.fr/ark:/12148/bpt6k5828837r
En 1717, Jean-Jacques Dortous de Mairan s’attarde également sur les végétations dans son livre Dissertation sur la glace, ou explication physique de la formation de la glace et de ses divers phénomènes : on trouvera le passage ici (il s’agit d’un livre fort intéressant les changements d’état) : lien.
48.856667 2.350987