Un article, un sujet ! Je ne sais pas vous, mais j’apprécie les histoires avec suite ; mettons donc un peu de piment à mon précédent article consacré à la démonstration de l’équation de Nernst ! J’invoque en effet une loi de la thermodynamique pour mener à bien ce raisonnement :
ΔrG = ΔrG° + RT ln K
Cela se poursuit en cascades : il nous faut maintenant démontrer cette loi-même !
Faisons un saut historique en 1867. Les chimistes norvégiens Cato Guldberg et Peter Waage mettent la main sur une théorie fondamentale de la chimie : la loi d’action de masse, qui porte parfois leur nom. Bien qu’il faille attendre le chimiste Van’t Hoff, qui formule sa célèbre relation (voir relation de Van’t Hoff), pour que la loi d’action de masse soit dotée de toute son envergure, elle n’en demeure pas moins l’année même de sa découverte un monument dans le monde de la chimie.
S’inscrivant dans la continuité des travaux de Claude Louis Berthollet, Henry Le Châtelier, et Willard Gibbs, elle stipule qu’une réaction chimique ayant atteint un équilibre est caractérisée par le fait que les concentrations des réactifs de départ et des produits formés sont reliées par une expression dont la valeur est constante à une température donnée. Cette expression n’est autre que la fameuse constante constante d’équilibre – K pour les intimes.
Gulgberg et Waage abordent également le fait que l’équilibre chimique soit dynamique, c’est-à-dire que des réactions se compensent (les vitesses de la réaction directe et de la réaction inverse étant égales), mais cela ne nous intéresse guère ici.
Nous savons qu’une réaction chimique évolue spontanément tant que son enthalpie libre pour un avancement donné est négative. Lorsque la variation d’enthalpie libre (ΔrG) est nulle, l’équilibre est atteint.
Il nous reste également à le démontrer ! Via la thermodynamique, bien sûr…
Thermochimie
D’après le deuxième principe, énoncé par Sadi Carnot en 1824, pour une transformation réversible à pression et température constantes, la chaleur (Q) est reliée à la température (en kelvins) et à l’entropie selon : DQ = TDS.
Or la variation d’enthalpie correspond à cette énergie libérée sous forme de chaleur au cours de la réaction. En effet, la variation d’enthalpie n’est autre que l’intégrale de l’enthalpie de réaction DrH par rapport à l’avancement ζ (voir opérateur de Lewis) :
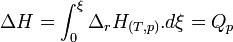
d’où, au cours de la réaction : DH < TDS ou DH – TDS < 0.
Cela s’écrit encore dH – TdS < 0
Cette expression est la différentielle (totale, ça tombe bien) d’une fonction d’état (des variables température, pression, quantité de matière, volume) appelée enthalpie libre (l’intégration conduisant à G = H – TS).
Or selon l’inéquation précédente, la variation d’enthalpie libre est négative !
On en déduit qu’à pression et température constantes, une réaction chimique a lieu spontanément (elle est exergonique), si et seulement si sa variation d’enthalpie libre est strictement négative.
Il s’ensuit, mathématiquement (le cas positif correspondant à une réaction nécessitant de l’énergie, i. e. endergonique), que l’annulation de la dérivée de la fonction d’état enthalpie libre par rapport à l’avancement traduit l’équilibre chimique. Dit autrement, l’évolution spontanée à pression constante d’un système thermostaté se fait vers les états qui ont une enthalpie libre minimale.
Un morceau est fait, mais nous sommes loin d’être au bout de nos peines ! On ne peut progresser dans le raisonnement qu’en introduisant le potentiel chimique :
l’enthalpie libre molaire partielle, autrement dit la dérivée de l’enthalpie libre par rapport à la quantité de matière d’un réactif est appelé potentiel chimique.
Fort logiquement, la variation d’enthalpie libre est reliée au potentiel chimique par la relation :
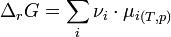
où ν désigne le coefficient stœchiométrique affecté à un réactif dans l’équation-bilan.
Par définition du potentiel chimique μ :
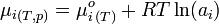
où, en plus de la constante des gaz parfaits (R) intervient l’activité chimique (a) et le potentiel chimique standard (μ°).
Nous venons de voir qu’à l’équilibre ΔrG=0, si bien que :
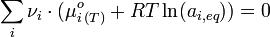
Or, à une certaine température, dans les conditions standard :
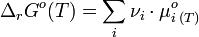
(comme nous l’avons déjà dit). Ainsi (voir les règles des symboles somme/produit) :
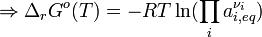
On a notamment passé le facteur ν à l’intérieur du log-népérien (en exposant, donc !)
On pose alors :
ΔrG° = - RT ln K°
où K est la constante d’équilibre (ici à l’état standard). On peut fort bien assimiler l’activité chimique aux concentrations (sauf dans le cas des gaz où la pression partielle doit être prise en compte). Dans ce cas, la loi d’action de masse s’exprime ainsi : à une température donnée, considérant une réaction chimique unique (c’est-à-dire un seul sens du double fléchage), le produit des concentrations en réactifs affectées d’un exposant correspondant au coefficient stœchiométrique de ce réactif est égal à une constante.
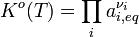
Or cela vaut pour les deux réactions en compétition dans le cas de réactions réversibles. Du coup, il existe une première constante d’équilibre associée au sens direct, et une seconde associée au sens indirect. Leur rapport, lui-même constant, égale le quotient des deux produits ci-dessus. Une constante d’équilibre globale régit donc une réaction chimique réversible, et voici que nous savons pourquoi elle dépend uniquement de la température : nos calculs ne sont vrais qu’à une température donnée, mais la relation de Van’t Hoff, déjà évoquée, permet de calculer la constante d’équilibre à une autre température en se basant sur l’approximation d’Ellingham (stipulant que les variations standard d’enthalpie et d’entropie, et par conséquent d’enthalpie libre, sont constantes dans un large domaine de température, à condition de se situer en dehors de tout changement de phase).
Toujours est-il que :
ΔrG° = - RT ln K°
Mais qu’en est-il dans des conditions non standard ? En fin de compte cette équation ne tient pas compte des conditions particulières d’un milieu biologique, par exemple…
Et pour cause, à l’équilibre, comme c’est le cas dans nos calculs sur la loi d’action de masse, ΔrG = 0. Il s’agit d’un cas particulier d’une équation plus vaste…
ΔrG = ΔrG° + RT ln K
CQFD !
Aussi du temps où j’étais en Terminale je ne comprenais pas d’où “sortait” l’expression de la constante d’équilibre. Cette démonstration est la preuve que les lumières de la thermodynamique illuminent la lanterne de la chimie. J’espère donc, qu’en plus d’éclairer sur les origines de l’équation de Nernst, ce travail en aidera certains dans la tâche fabuleuse de compréhension de la chimie ! Chimie qui ne peut donc se passer de la physique…
Tant que nous y sommes, démontrons la relation de Van’t Hoff. C’est très simple :
Première méthode : il suffit d’effectuer le quotient de deux variations d’enthalpie libres de la même réaction, c’est-à-dire à deux températures différentes, la constante d’équilibre ne dépendant que ce dernier paramètre. Soit…
ΔrG(1)/ΔrG(2)=(ΔrG° + RT ln K(1))/ΔrG° + RT ln K(2))
Or ΔrG(1) = ΔrH – T(1)ΔrS, et ΔrG(2) = ΔrH – T(2)ΔrS…
Seconde méthode : d’après l’équation ΔrG° = - RT ln K, K = e-ΔrG°/RT. On effectue alors le rapport de deux constantes d’équilibre, à deux températures différentes, forcément, puis on prend le logarithme népérien de ce rapport.
ln [K(1)/K(2)] = ln K(1) – ln K(2) = [ΔrG/RT(1)]/[ΔrG/RT(2)].
Or ΔrG(1) = ΔrH – T(1)ΔrS, et ΔrG(2) = ΔrH – T(2)ΔrS…
Au final :
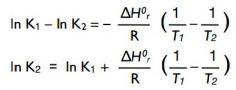
ou encore :
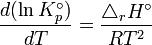
Si T2 > T1, le terme entre parenthèses est positif : il en découle que la constante d’équilibre d’une réaction endothermique (ΔrH>0) augmente avec la température. De même, la constante d’équilibre d’une réaction exothermique diminue lorsque la température augmente.
Cela confirme le principe empirique de Le Châtelier, relatif à la modération d’une perturbation. Dans le cas d’un gaz, l’augmentation de la pression partielle d’un constituant déplace l’équilibre dans le sens d’une diminution de pression, donc dans le sens de la consommation de cet excédent. Dans le cas d’une solution, l’augmentation de la concentration d’un produit freine la réaction dans le sens qui le produit, et l’augmente dans le sens qui le consomme – en tant que réactif, donc !
On a démontré seulement la relation faisant intervenir l’enthalpie, dans le cas d’une transformation isobare, mais une relation similaire existe pour les transformations isochores : il n’y a qu’à remplacer l’enthalpie par l’énergie interne.
48.856667 2.350987