Le célèbre McGyver est connu pour avoir plus d’un tour dans son sac :
Dans cet épisode, il parvient à colmater une fuite d’acide sulfurique mettant sa vie et celle d’une demoiselle en danger… grâce à du chocolat ! Décryptage…
Chocolat contre acide
L’acide sulfurique est un acide fort, donc fort redoutable pour l’organisme : il est régulièrement la cause de brûlures graves. De puissance seulement égalée par les superacides, il est bien peu prudent de s’approcher de celui qu’on appelle aussi vitriol sans protection. Et pourtant, McGyver vient à bout de l’acide sulfurique avec du chocolat !
S’il se dépatouille de cette situation, c’est grâce au pouvoir de la chimie. Comme il le rappelle, le chocolat contient divers sucres, tels le glucose, le lactose, ou le saccharose (et renferme également des polyols, ou sucres-alcools, tel le sorbitol). Or, la formule brute d’un sucre s’apparente à Cn(H2O)p : un sucre peut se voir comme un assemblage d’atomes de carbone et de molécules d’eau (d’où leur appellation anglo-saxonne : carbohydrates).
Au contact de l’acide, les sucres du chocolat (comme les diholosides) se déshydratent. S’agissant du lactose (possédant des dizaines d’isomères, même si tous ne sont pas présents dans le chocolat), voici la réaction :
C12H22O11(s) + H2SO4(l) → 12 C(s) + 12 H2O(l) + SO2(g)
D’après Wikipédia, en raison du caractère thermodynamiquement favorable de l’hydratation de l’acide sulfurique, celui-ci est utilisé industriellement comme agent de dessiccation,notamment dans l’agro-alimentaire pour élaborer des fruits secs. Cet effet est si marqué que l’acide sulfurique peut brûler les matières organiques en ne laissant que le carbone, par exemple avec l’amidon :
(C6H10O5)n → 6n C + 5n H2O
L’eau libérée par cette réaction est absorbée par l’acide sulfurique, et il ne reste qu’un résidu carboné. La cellulose du papier, lorsqu’elle est attaquée par de l’acide sulfurique, prend un aspect carbonisé sous l’effet d’une réaction similaire.
Cette réaction est hautement exothermique : ne serait-ce que la solvatation de l’acide sulfurique libère de la chaleur, à hauteur de 95,28 kJ/mol. En plus de produire une mousse noire, composée de carbone, les bulles sont dues à la réaction chimique : l’eau produite se vaporise sous l’effet de la chaleur.
La réaction est des plus spectaculaires. Voyez donc la vidéo ci-dessous !
Mais aussi, cette vidéo-là (sucre+acide sulfurique) en met plein les yeux :
On peut penser que l’échappement de carbone colmate la fuite, donc McGyver ne raconte pas des bobards (ça n’est pas dans ses habitudes !).
Pour en savoir plus
Il se passe en fait plein de choses dans cette expérience… Je me suis bien gardé d’équilibrer la réaction ci-dessus, pour la bonne raison qu’elle ne correspond pas vraiment à la réalité. En effet, en toute rigueur l’acide sulfurique ne doit pas apparaître dans l’équation-bilan, étant donné qu’il catalyse la réaction de décomposition des sucres. Il est bon de la décomposer en actes élémentaires…
L’eau formée, en plus de celle présente dans le chocolat (comme tout produit issu du vivant le chocolat est composé d’eau) a tendance à agir comme une base dans la réaction avec l’acide sulfurique :
H2SO4 + H2O → H3O+ + HSO4−
Se produit alors une autre réaction :
HSO4− + H2O → H3O+ + SO42−
Au bilan :
H2SO4 + 2 H2O → 2 H3O+ + SO42-
Une réaction d’oxydoréduction a également lieu. En effet, le carbone passe d’un degré d’oxydation supérieur à 0 dans le saccharose, au degré d’oxydation 0 dans le carbone pulvérulent.
Une demi-équation est :
SO42− + 4 H+ + 2 e- → SO2 + 2 H2O
Il y a donc formation de dioxyde de soufre (par réduction d’un peu d’acide sulfurique par le carbone formé). Le dioxyde de soufre est un gaz toxique, nécessitant de réaliser la réaction sous une hotte d’aspiration. Il s’agit d’une molécule coudée et hypervalente dont l’atome de soufre, à un degré d’oxydation de + IV, possède un doublet électronique non liant, donnant lieu à une délocalisation électronique (mésomérie), ce qui lui confère une certaine stabilité :
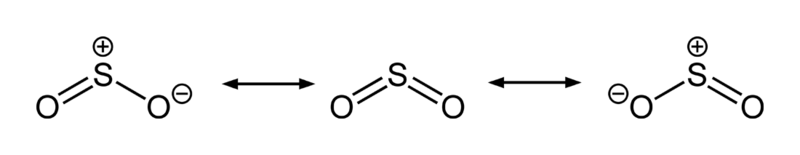
Formes de résonance du dioxyde de soufre.
Mais si jamais du platine ou du vanadium sont présents dans le milieu pour assurer la catalyse (sait-on jamais !), le dioxyde soufre réagit à son tour avec le dioxygène de l’air :
2 SO2 (g) + O2 (g) 
A cette réaction de combustion correspond une variation d’enthalpie de – 197 kJ/mol : elle est hautement exothermique.
Dans ce cas, le trioxyde de souffre formé réagit avec l’eau pour donner l’acide sulfurique. Bref, on tourne en rond ! SO3 + H2O → H2SO4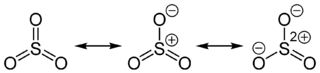
Formes de résonance de l’éphémère trioxyde de soufre.
Caramélisation
La réaction mise à profit par McGyver est proche de la caramélisation, ou formation du caramel : d’aucuns ne savent que le caramel est issu du chauffage du sucre ! L’hydrolyse du saccharose (sucre de table) est provoquée par la chaleur, et souvent catalysée par l’acide citrique. Elle conduit à des sucres complexes (polydextroses et oligosaccharides), et produit de l’eau. L’eau peut s’évaporer ; dans ce cas les sucres, déshydratés deviennent du carbone pur. La caramélisation à outrance n’est autre que la carbonisation des sucres.
Avec de l’acide sulfurique concentré, ou sous haute température avec de l’acide sulfurique dilué, le saccharose subit une déshydratation intense : le résidu est du carbone.
Un sucre est un composé organique : il est riche en carbone, hydrogène, oxygène… Avec la température, il carbonise donc !
On notera que si les acides catalysent l’hydrolyse des liaisons osidiques (présentes au sein des sucres), c’est parce qu’ils favorisent le cassage des liaisons : les protons qu’ils dégagent ont en effet tendance à arracher des électrons, donc à briser les liaisons covalentes.
D’autre part, la caramélisation ne se produit pas au moindre réchauffement d’une brioche au sucre, car la température de caramélisation du saccharose est de 160° C !

Les caramels (ici en brownie au beurre salé) sont le produit brunâtre de dégradation du saccharose.
La caramélisation n’est d’ailleurs qu’une réaction de polymérisation (assemblage) des sucres que j’évoque dans un article : lien. D’après ce que j’y raconte, plus un polymère est réticulé (enchaîné), plus il est solide. C’est la même chose pour le caramel : plus un caramel est réticulé, plus il est visqueux, voire solide : on peut les manger comme n’importe quelle friandise, et non plus seulement boire !
La caramélisation appartient au groupe des réactions non enzymatiques de brunissement des aliments, telle les réactions de Maillard, responsables notamment de la belle couleur dorée des baguettes de pain.
Bien entendu, les enzymes (biocatalyseurs) peuvent accélérer la transformation des sucres. Le sucre inverti est un mélange équimolaire de glucose et de fructose obtenu par hydrolyse du saccharose. L’hydrolyse, si elle n’est pas catalysée par un acide, l’est par l’enzyme invertase : C12H22O11 (saccharose) + H2O (eau) → C6H12O6 (glucose) + C6H12O6 (fructose).
En présence d’une solution acide, l’hydrolyse du saccharose conduit donc au sucre inverti (mélange de D-glucose et de D-fructose).
Dans les boissons, l’hydrolyse acide (acide citrique, acide phosphorique) se produit partiellement. Plus la boisson est acide (Coca), plus l’hydrolyse est rapide.
Le sirop de sucre inverti est d’ailleurs utilisé dans l’industrie culinaire pour son pouvoir sucrant (surtout du au fructose) et parce qu’il ne dessèche pas. On le retrouve dans les glaces et les sorbets…
Le nom de sucre inverti est du à l’inversion du plan de polarisation de la lumière polarisée : une solution de saccharose dévie ce plan vers la droite (le saccharose est dit dextrogyre), tandis que le mélange glucose – fructose résultant de l’hydrolyse du saccharose le dévie vers la gauche (mélange lévogyre). Il y a donc inversion du plan de rotation, d’où sucre inverti.
Conclusion
En résumé, la réaction de déshydratation-carbonisation des sucres, telle qu’expérimentée par McGyver, relève d’une catalyse acide générale, nécessitant tout-de-même un acide assez fort pour être si impressionnante (le pKa de l’acide sulfurique vaut -3 !).
L’hydratation de l’acide sulfurique, produisant des clusters (agrégats atomiques) a même été l’objet d’une étude de physique quantique : http://pubs.acs.org/doi/abs/10.1021/jp2119026.
Pour le plaisir des yeux, on peut encore revoir la réaction dans cette vidéo-ci, plus détaillée, avec en fond sonore la chanson idéale : Sugar sugar des Archies (1968).
Bien entendu, étant donné la multitude d’espèces chimiques présente dans le chocolat, bien d’autres réactions ont lieu avec l’acide sulfurique (en plus des divers composés organiques, des cations, tel que le magnésium Mg2+ abondamment présent dans le chocolat, peuvent participer à des réactions d’oxydoréduction), mais seule la déshydratation des sucres importe dans la prouesse réalisée par McGyver.
Le chocolat
Ne nous arrêtons pas en si bon chemin ! Le chocolat noir se compose principalement de beurre de cacao, issue de la pression des fèves de cacao, qui, comme chacun sait, sont issues du cacaoyer. Il contient surtout de l’acide palmitique, stéarique, oléique, arachidique, et linoléique, ce qui ne signifie pas qu’il faille s’affoler de cette composition riche en matières grasses : non seulement, elles apparaissent par teneur décroissante, mais surtout la bicouche lipidique de nos cellules nécessite un apport suffisant en gras !

La fève de cacao, d’où est issue après torréfaction le beurre de cacao.
Le beurre de cacao, à la composition proche de celui de karité, est une des graisses les plus stables, car il contient des antioxydants naturels qui empêchent le rancissement et lui confèrent une durée de stockage de deux à cinq ans. Bien entendu, le goût n’est pas le même après un certain temps passé au placard…
Pour 100 g, le cacao, constituant principal du chocolat, contient 3 g d’eau pour 40 g de glucides (dont une majorité de sucres) !
Le chocolat blanc étant presque dépourvu de cacao, la réaction chimique avec l’acide sulfurique est théoriquement moins importante. En réalité, ce déficit en cacao est compensé par l’ajout de sucre !

Rêvez donc à la vue de ces carrés de chocolat ! S’il est universellement apprécie, c’est en raison de sa haute teneur en sucres.
Le chocolat est réputé pour ses propriétés d’antidépresseur, dues à la présence d’un acide aminé rare, le tryptophane, précurseur de la sérotonine. Le mode d’action du chocolat est donc le même que celui des médicaments antidépresseurs appelés inhibiteurs de la recapture de la sérotonine : il augmente la production de sérotonine, de même que les molécules synthétiques augmentent sa concentration au niveau des synapses.
Parmi les antioxydants présents dans le chocolat, on retrouve les polyphénols, la catéchine et l’épicatéchine.
Concernant les supposées vertus aphrodisiaques du chocolat, tout du moins le bien-être qu’il procure en grande quantité, elles sont dues à la présence de phényléthylamine, un alcaloïde endogène que j’évoque dans un article abordant notamment les liens entre sexe et chimie. Pour avoir un effet réel, le chocolat doit vraiment être beaucoup consommé, sinon la phényléthylamine est neutralisée par l’enzyme monoamine oxydase B, retrouvée notamment dans les thrombocytes (plaquettes). Néanmoins, dans le cadre de la maladie de Parkinson, à cause du traitement aux inhibiteurs des monoamine oxydases, l’effet relaxant du chocolat est plus net.
L’anandamide, substance endogène également, c’est-à-dire que notre cerveau la fabrique (elle fait partie des endocannabinoïdes), est présente en quantité très faible : elle agit sur les mêmes récepteurs que le cannabis, mais en raison des quantités infimes du chocolat, son effet sur le psychisme fait débat.
L’or noir – si l’on peut dire – contient bien sûr, en plus de quantités importantes de magnésium, du phosphore, du zinc, du potassium et du fer. Des arômes sont ajoutés pour l’adoucir, telle la vanilline.
On retrouve bien sûr de nombreuses vitamines, en particulier A, D et E, ainsi que les vitamines du groupe B.
Mais aussi, le chocolat contient de l’acide oxalique : à consommer avec modération donc, car l’acide oxalique participe à la formation des calculs rénaux.
Le chocolat est un poison pour les animaux
Le chocolat est riche en méthylxanthines : théophylline et théobromine (proche de la caféine). De même que le paracétamol est mortel pour les chats, mais aussi pour les chiens (et les serpents !) dans une moindre mesure, de nombreux chiens finissent régulièrement aux urgences pour intoxication au chocolat ! Nos amis les chiens n’ont pas les enzymes pour métaboliser la théobromine : interdit donc le chocolat ! Dans l’intoxication au paracétamol, les vétérinaires peuvent bien sûr procéder rapidement à l’injection de glucuronyl transferase humaine, mais concernant le chocolat et les animaux, la prévention reste le meilleur remède, car il est souvent trop tard…
50 grammes de chocolat suffisent à tuer un chien de taille moyenne. Pire… La théobromine a une demi-vie assez longue et sa clairance animale (capacité à l’éliminer) est mauvaise : carré après carré, la molécule s’accumule et l’animal peut succomber longtemps plus tard, sans cause apparente.
Aussi, en raison de l’absence de récepteurs perfectionnés du goût, les chats sont moins susceptibles d’avaler une tablette de chocolat (cela n’a pas si bon goût pour eux) ; en revanche un chien peut faire une overdose de chocolat…
Theobroma cacao est d’ailleurs le nom scientifique du cacaoyer…
48.856667 2.350987