Il ne faut pas espérer un miracle, mais une perte de poids moyenne de moins de 4% et sous condition de réduire ses apports caloriques et de faire de l'exercice. Il s'agit de Belviq® (chlorhydrate de lorcaserin), qui vient d'être approuvé par l'Agence américaine Food and Drug administration (FDA) pour le traitement du surpoids et de l'obésité, en complément à un régime réduit en calories et à la pratique de l'exercice physique. Plus spécifique à la gestion de poids chronique, le médicament vient d'être approuvé pour les adultes avec un indice de masse corporelle (IMC) de 27 ou plus, présentant au moins une comorbidité, comme une hypertension, un diabète de type 2, ou un taux de cholestérol élevé.
Le mode d'action de Belviq® passe par l'activation du récepteur de sérotonine dans le cerveau et contribue ainsi à réduire chez le patient, la sensation de faim, après avoir mangé de petites quantités de nourriture et à « accélérer » ainsi la sensation de de satiété. L'innocuité et l'efficacité du nouveau médicament ont été évaluées dans 3 études randomisées, sur un total de près de 8.000 patients obèses et en surpoids, avec et sans diabète de type 2, traités pendant 52 à 104 semaines et suivant un régime calorique réduit et pratiquant un minimum d'exercice.
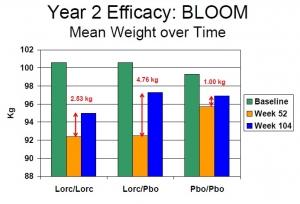
Une perte de poids moyenne de 3 à 3,7% sur un an (Voir figure ci-contre):
· Environ 47% des patients sans diabète de type 2 ont perdu au moins 5% de leur poids corporel vs 23% des patients traités par placebo.
· 38% des patients diabétiques de type 2 traités par Belviq vs 16% par placebo ont perdu au moins 5% de leur poids corporel.
· Belviq a été associé à un contrôle glycémique amélioré chez les diabétiques de type 2.
En cas d'inefficacité du médicament après 12 semaines, le traitement doit être interrompu. Ces patients seront en effet peu susceptibles d'atteindre une perte de poids cliniquement significative avec la poursuite du traitement. Des effets indésirables, tout de même : Belviq ne doit pas être utilisé pendant la grossesse et peut provoquer des effets indésirables graves. Rappelons qu'en 1997, les médicaments de perte de poids à base de fenfluramine (Isoméride) et de dexfenfluramine ont été retirés du marché après constatation d'effets secondaires cardiaques graves. L'effet de Belviq sur le fonctionnement de la valve cardiaque a été évalué par échocardiographie et aucune différence statistiquement significative ou anomalies de la valve n'ont été constatées durant les essais avec Belviq. Le fabricant du médicament devra encore mener 6 études post-commercialisation, y compris sur les effets cardio-vasculaires de Belviq et le risque d'événements cardiaques majeurs tels que la crise cardiaque ou l'AVC. En 2010, le comité de la FDA avait émis un avis négatif, pour soupçons de risque de cancer du sein, sur l'AMM Lorcaserin.
Source: FDA « FDA approves Belviq to treat some overweight or obese adults”
Accéder à nos dossiers-Pour y accéder, vous devez êtreinscritet vous identifier
Obésité de l'enfant (1/6)
Troubles du comportement alimentaire

