 Il s'agit de la première thérapie génique recommandée pour approbation en UE et elle est indiquée pour une maladie très rare du métabolisme des triglycérides, le déficit en lipoprotéine lipase. Le Comité des Médicaments à usage humain (CHMP) de l'Agence européenne du médicament vient ainsi de recommander l'autorisation de Glybera (alipogène tiparvovec), un nouveau traitement pour les patients victimes d'accès de pancréatites aigües ou multiples liées à ce déficit héréditaire. Une fois son AMM confirmée, Glybera pourra donc être disponible en UE pour les patients les plus en urgence de traitement.
Il s'agit de la première thérapie génique recommandée pour approbation en UE et elle est indiquée pour une maladie très rare du métabolisme des triglycérides, le déficit en lipoprotéine lipase. Le Comité des Médicaments à usage humain (CHMP) de l'Agence européenne du médicament vient ainsi de recommander l'autorisation de Glybera (alipogène tiparvovec), un nouveau traitement pour les patients victimes d'accès de pancréatites aigües ou multiples liées à ce déficit héréditaire. Une fois son AMM confirmée, Glybera pourra donc être disponible en UE pour les patients les plus en urgence de traitement.
Le déficit en lipoprotéine lipase est une maladie héréditaire, liée à un gène défectueux, qui touche une personne environ sur 1 million,entraînant chez certains patients atteints, des accès de pancréatites aigües ou multiples. Alors que les triglycérides servent de carburant aux divers tissus de l'organisme, la Lipoprotéine Lipase est l'enzyme qui permet de dégrader les triglycérides en acides gras et glycérol,qui seront captés par les cellules pour leurs besoins énergétiques. Une carence en lipoprotéine lipase induit une hypertriglycéridémie massive, entraînant des douleurs abdominales qui peuvent signifier le début d'un accès de pancréatite aiguë. Le traitement de ce déficit est un régime à vie pauvre en graisses.
Alors qu'il est extrêmement difficile de se conformer à une réduction aussi stricte des graisses alimentaires, en deçà de 10 à 20% de l'apport calorique quotidien, de nombreux patients connaissent des accès de pancréatite, mettant leur vie en danger et nécessitant généralement une hospitalisation.
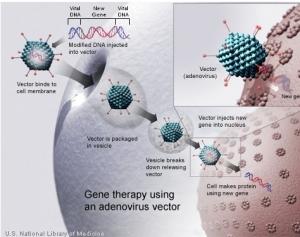
Glybera est la première thérapie génique recommandée pour une autorisation en UE. Le médicament agit en remplaçant le gène défectueux par une « copie de travail », permettant ainsi au corps de récupérer cette fonctionnalité. Glybera utilise un adénovirus comme véhicule de livraison des copies du gène dans des cellules musculaires pour induire à nouveau la production de l'enzyme dans les cellules.
Les « circonstances exceptionnelles » justifient, pour le CMHP cette recommandation d'approbation, sachant que le laboratoire fabricant devra fournir les résultats de traitement avec Glybera, dont, dans un premier temps, l'indication sera restreinte aux patients les plus en besoin de traitement. A ce jour, les résultats des essais, dont un récent fait l'objet d'un article récent dans la revue Nature, ont conduit le CHMP à conclure à un rapport bénéfice-risque positif, du moins en fonction des risques connus. La demande d'autorisation de mise sur le marché pour Glybera a été soumise à l'Agence européenne en décembre 2009, en juin 2011, le CHMP émettait un avis négatif, puis, en juin 2012, après réévaluation et discussions scientifiques un projet d'avis positif qui vient donc d'être approuvé par le CHMP.
Source: Agence européenne des médicaments Communiqué Glyberaet Nature 21 June 2012 doi:10.1038/gt.2012.43Efficacy and long-term safety of alipogene tiparvovec (AAV1-LPLS447X) gene therapy for lipoprotein lipase deficiency: an open-label trial


