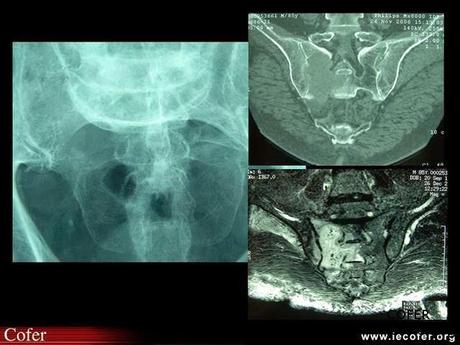
Métastase sacrée d'un cancer de la prostate, révélée par une sciatique S1 droite sans syndrome rachidien.
Source iconographique et légendaire: http://galerieunf3s.univ-nantes.fr/main.php?g2_itemId=5234
L’essai ARADES est une étude ouverte de phase 1-2 effectuée dans 23 hôpitaux en Europe et aux États-Unis avec suivi continu à long terme. Des hommes atteints de cancer de la prostate métastatique résistant à la castration, montrant des concentrations de testostérone correspondant à la castration et avec statut de rendement ECOG (Eastern Cooperative Oncology Group) de 0-1 ont été recrutés. Au cours de la période de phase 1 de l’étude, les patients ont reçu ODM-201 à raison de 200 mg/jour comme dose de départ, dose qui a par la suite été portée à 400 mg, 600 mg, 1000 mg, 1400 mg, et 1800 mg/jour.Au cours de la phase 2, les patients ont été répartis de manière aléatoire par système centralisé et stratifiés selon les chimiothérapies précédemment administrées et le traitement aux inhibiteurs de CPY17, pour recevoir l’une des trois doses d’ODM-1 administrées quotidiennement (200 mg, 600 mg, et 1400 mg). Le critère principal d’évaluation de la phase 1 était l’innocuité et la tolérance ; le critère d’évaluation principal de la phase 2 étant la proportion de patients montrant une réponse PSA (réponse = baisse de 50% ou plus de la PSA sérique) à la semaine 12. Toutes les analyses incluaient les patients ayant reçu au moins une dose de ODM-201. (…).
Nous avons recruté les patients entre le 5 avril 2011 et le 12 mars 2013. Pour la phase 1, 24 patients ont été recrutés en six cohortes séquentielles de trois à six patients et ont reçu une dose quotidienne de ODM-201, de 200-1800 mg. Aucun effet toxique dose-dépendant n’a été relevé, et la dose maximale tolérée n’a pas été atteinte. Dans la phase 1, trois patients ont rapporté huit évènements indésirables de grade 3 (fracture, lésions musculaires, lacération, ileus paralytique, douleur, présyncope, rétention urinaire, vomissements) et un patient a montré un évènement indésirable de grade 4 (lymphoedème). Aucun des évènements indésirables de grade 3-4 n’a été considéré comme lié à la prise de ODM-201. Parmi les patients de phase 1, quatre patients qui recevaient 200 mg, sept qui recevaient 400 mg et trois qui recevaient 1400 mg ont intégré la phase 2 de l’essai. En complément des patients précités, 110 supplémentaires ont été randomisés de manière aléatoire en trois groupes : 200 mg (n=38), 400 mg (n=37), et 1400 mg (n=35). Pour ces patients, les évènements indésirables les plus fréquents dus au traitement étaient fatigue ou asthénie (15 [12%] patients sur 124), bouffées de chaleur (six [5%]), et diminution d’appétit (cinq [4%]). Un patient (<1%) a montré un évènement indésirable de grade 3 lié au traitement (fatigue) ; aucun patient n’a montré d’évènement indésirable lié au traitement de grade 4. 38 patients qui recevaient 200 mg, 39 qui recevaient 400 mg, et 33 qui recevaient 1400 mg ont pu être évalués pour ce qui est de la réponse PSA à 12 semaines. 11 (29%) patients du groupe 200 mg, 13 (33%) du groupe 400 mg, et 11 (33%) du groupe 1400 mg ont montré une réponse PSA à 12 semaines.
Nos résultats suggèrent que ODM-201 administré en monothérapie à des hommes atteints de cancer de la prostate métastatique progressif et résistant à la castration fournit une suppression de la maladie, et montre un profil d’innocuité favorable. Ces résultats sont en faveur de la poursuite de futures recherches relatives aux réponses cliniques obtenues avec ODM-201 chez des hommes atteints de cancer de la prostate résistant à la castration. Prof Karim Fizazi MD et al, dans The Lancet Oncology, publication en ligne en avant – première, 26 juin 2014
Financement : Orion Corporation, Orion Pharma, Endo Pharmaceuticals Inc.
Source : The Lancet Online / Traduction et adaptation : NZ
