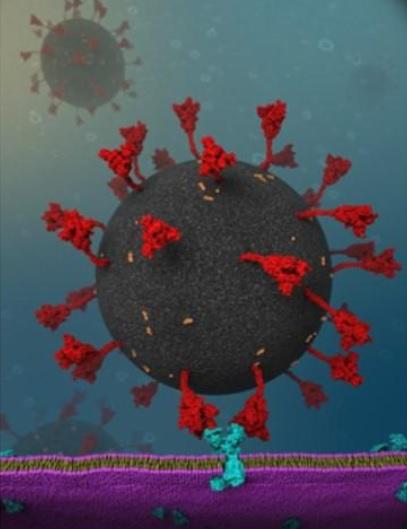
Une protéine de pointe plus robuste explique la virulence des variants, avait déjà suggéré une récente étude publiée dans la revue Science. Dans cette nouvelle recherche, les scientifiques de l’Université de Lehigh (Pennsylvanie) identifient une interaction virus-cellule très spécifique qui contribue à expliquer le taux élevé d'infection du SARS-CoV-2-en comparaison du précédent coronavirus SRAS (SARS-CoV-1). Ces travaux, publiés dans le Biophysical Journal qui décryptent avec une précision jusque-là inégalée le processus de verrouillage entre la protéine de pointe du SRAS-CoV-2 et les récepteurs ACE2, révèlent le rôle clé des glycanes attachés au récepteur ACE2. Ces travaux inspirent ainsi le développement de nouvelles stratégies pour bloquer l'entrée du SRAS-CoV-2 dans les cellules hôtes.
La protéine S possède une tige très flexible composée de 2 articulations indépendantes. Cette flexibilité permet au domaine de liaison au récepteur d’adopter différentes orientations (voir visuel). Mais ce n’est pas la seule explication de cette infectiosité élevée. Les auteurs principaux, X. Frank Zhang et Wonpil Im avaient appris d’études récentes que l'interaction entre la protéine de pointe du SRAS-CoV-2 et les récepteurs de l'enzyme de conversion de l'angiotensine 2 (ACE2) dans les cellules humaines est plus forte que l'interaction entre la protéine de pointe du (précédent) SRAS. Les chercheurs ont donc cherché à caractériser ces interactions protéine-protéine lors du processus d’infection.
Le rôle clé des glycanes attachés aux récepteurs ACE2
A l’aide d’une technique appelée « spectroscopie de force à molécule unique » (single-molecule force spectroscopy) et de simulations de dynamique moléculaire, l’équipe a découvert une interaction jusque-là inconnue entre les glycanes, des groupes de sucre attachés à la surface des protéines ACE2, et le pic de SRAS-CoV-2. Par simulations, les scientifiques font l’hypothèse d’une interaction supplémentaire RBD (domaine de liaison)-N-glycane qui contribue à une plus grande force et à une durée d’interaction plus longue entre S et ACE2.
La spectroscopie de force permet de confirmer cette hypothèse.
Lorsque les scientifiques éliminent les glycanes attachés à ACE2, la force de liaison mécanique avec SARS-CoV-2 « RBD » revient à un niveau similaire à celui de l'interaction constatée entre SARS-CoV-1 et ACE2.
La liaison glycosidique contribue ainsi à la puissance de l'interaction du virus SARS-CoV-2/cellule hôte.
Source: Biophysical Journal March 16, 2021 DOI:https://doi.org/10.1016/j.bpj.2021.02.007 Biomechanical characterization of SARS-CoV-2 spike RBD and human ACE2 protein-protein interaction
Lire aussi : COVID-19 : Une protéine de pointe plus robuste explique la virulence des variants
Équipe de rédaction SantélogMar 31, 2021Rédaction Santé log
