Les états de la matière
Tout le monde connait les 3 états de la matière : solide, liquide et gaz. Cependant, peu de personnes sont capables de bien définir ces 3 états et il en existe d’autres que peu de gens connaissent.

Les états « classiques »
Prenez un glaçon (solide), mettez le dans une casserole et chauffez le : le glaçon va fondre en eau (liquide) puis l’eau va se vaporiser en vapeur (gaz). Ca y est, vous venez d’explorer la matière dans tous ses états !
Pour comprendre les différents états de la matière, on peut dessiner un diagramme de phases qui représentent les 3 états (ou phases) d’un élément en fonction de sa température et de sa pression. Dans le cas de l’eau à pression atmosphérique (1 bar), la phase est solide en dessous de 0°C, liquide entre 0°C et 100°C et gazeuse au dessus de 100°C. Le passage d’une phase à une autre porte un nom précis et se réalise à pression et à température constante, il y a donc des points (en fait des lignes) où 2 états de la matière coexistent lors du changement de phase.
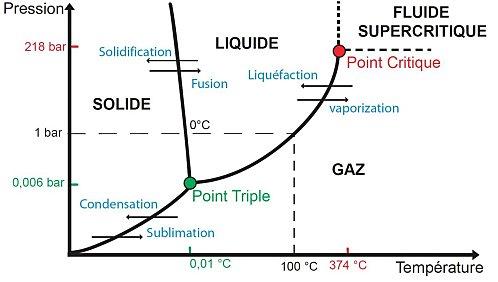
Diagramme de phases de l’eau
Il faut bien comprendre que pour connaitre l’état d’un élément, il ne suffit pas de connaitre sa température: sa pression est également indispensable! Par exemple, on peut obtenir de la vapeur d’eau à -10°C à très basse pression et de l’eau liquide à 300°C sous haute pression, ce qui peut s’avérer très pratique. L’eau liquide pressurisée à environ 300 °C est par exemple utilisée dans certains réacteurs nucléaires pour refroidir le cœur de la centrale (centrales de type EPR), voir ce billet sur le blog d’Alexandre Moatti.
Il existe également 2 points particuliers :
- Le point triple où les 3 états coexistent ensemble (0,006 bar et 0,01°C pour l’eau).
- Le point critique : au-delà de ce point, liquide et gaz ne sont plus distinguables et on parle alors de fluide supercritique (218 bar et 374 °C pour l’eau). C’est en quelque sorte un état indéfini, car au-delà de ce point, les transitions de phase sont impossibles et donc il n’est plus possible de distinguer gaz et liquide.
Caractéristiques microscopiques et propriétés
Les solides sont caractérisés par un agencement des atomes très ordonnés et rapprochés. Il est donc très difficile de les comprimer car il y a peu d’espace entre les atomes. De plus, tous les atomes sont liés fortement les uns aux autres, ce qui confère aux solides une forme propre bien délimitée dans l’espace.
Les liquides sont caractérisés quant à eux par un agencement désordonnés des atomes mais toujours assez rapprochés, ils sont donc également difficilement compressibles. En revanche, les atomes sont peu liés les uns aux autres et les liquides ne possèdent donc pas de forme propre et peuvent d’évaporer facilement.
Les gaz sont caractérisés par un agencement des atomes désordonnés et espacés et peuvent ainsi être comprimé facilement. Les atomes ne sont pas liés les uns aux autres et sont très agités. Pour ces raisons, les gaz se répandent librement et n’ont pas de forme propre sans pouvoir être délimité.
Le verre

Mais attention tout de même, contrairement à certaines croyances, le verre ne coule pas et si les vitres de Versailles sont plus épaisses en bas qu’en haut ce n’est pas parce que le verre a coulé mais à cause du procédé de fabrication de l’époque.
La matière molle

La matière molle est une appellation qui regroupe les colloïdes (substances ayant 2 phases dont les particules d’une phase sont très petites et diffusées dans l’autre phase comme une mousse au chocolat), les cristaux liquides (les écrans de vos montres électroniques) et les polymères (ensemble de macromolécules comme les plastiques). Cette physique de la matière molle est très récente et a émergée il y a une quarantaine d’années, particulièrement avec le prix Nobel de physique français Pierre-Gilles De Gennes. L’étude de la matière molle constitue toujours un intérêt majeur pour la recherche qui ne cesse de progresser dans la compréhension de ces états de la matière qui intriguent.
Le plasma
Le plasma est un quatrième état de la matière bien à part qui est caractérisé par le fait que les électrons peuvent se mouvoir librement alors que dans les trois autres phases classiques (solide, liquide et gaz), les électrons sont liés aux noyaux des atomes en gravitant autour. Les plasmas sont obtenus en portant à très haute température un gaz ou en appliquant un important champ électrique, on parle alors de gaz ionisé.
Les plasmas sont très répandu dans l’univers (étoiles, quasars, pulsars) mais sont également présents dans des phénomènes naturels terrestres comme les aurores boréales ou plus simplement les éclairs. Dans les applications domestiques, certains téléviseurs plats (écrans plasmas) utilisent cet état de la matière ainsi que dans ces fameuses « boules à plasma » qu’on trouve dans certains magasins de gadgets.

Superfluide
Il existe également d’autres états bien distincts des autres par leurs propriétés exceptionnelles. C’est le cas des superfluides qui ne présentent pas de viscosité (ils s’écoulent parfaitement) à très basse température. Ce phénomène est observé uniquement en laboratoire et se produit avec de l’hélium refroidis en dessous de -271°C (2,2 K). Voir un de mes billets précédents sur les supers états.
Il existerait également un phénomène analogue sur les solides (supersolides) mais les observations sont encore controversées… Affaire à suivre.
Tout cela pour vous faire comprendre que la matière est parfois plus complexe qu’il n’y parait et que même les physiciens ont du mal à classer et comprendre toutes ces formes de matière parfois étranges.
Par Benjamin Bradu - Publié dans : PhysiqueEcrire un commentaire 1 - Voir le commentaire - Voir les 1 commentaires - Partager ' ); YAHOO.util.Selector.query( 'input', dial.getEl(), true ).focus(); }, this, true ); return false; " title="Partager par adresse simplifiée"> Précédent : L’antimatière mise en boite au CERN Retour à l'accueil
