 Un pas de plus vient d'être franchi pour soigner ou, au moins, pour comprendre, la cécité. Ces scientifiques viennent en effet de cultiver une structure similaire à la rétine, à partir de cellules souches embryonnaires de souris. Un œil embryonnaire, pourrait-on dire, qui, si son fonctionnement est satisfaisant et si la greffe s'avérait possible sur l'Homme, pourrait être un ultime recours en cas de cécité. Une étape importante en recherche sur la rétine, publiée dans la revue Nature.
Un pas de plus vient d'être franchi pour soigner ou, au moins, pour comprendre, la cécité. Ces scientifiques viennent en effet de cultiver une structure similaire à la rétine, à partir de cellules souches embryonnaires de souris. Un œil embryonnaire, pourrait-on dire, qui, si son fonctionnement est satisfaisant et si la greffe s'avérait possible sur l'Homme, pourrait être un ultime recours en cas de cécité. Une étape importante en recherche sur la rétine, publiée dans la revue Nature.
Cette structure embryonnaire de la rétine comprend à la fois une couche de pigments contenant des cellules, une couche de cellules nerveuses, ce qui en fait une structure similaire à la rétine. Cependant, de nouvelles recherches seront nécessaires pour déterminer si ces structures fonctionnent de la même façon, si ces cellules peuvent être transplantées avec succès et si elles améliorent la vue une fois greffées dans l'œil. Ces expériences devront encore être réalisées chez l'animal avant de pouvoir être envisagées chez l'homme.
Même si ces rétines cultivées en laboratoire finalement se révèlaient inadaptées pour des greffes, elles devraient aider les scientifiques à mieux comprendre comment la rétine se développe et comment elle est affectée par la maladie. Ces rétines artificielles peuvent également être utiles pour tester les effets de divers médicaments sur la rétine en laboratoire. Cette étude menée par des chercheurs du Centre de biologie du développement RIKEN et autres centres de recherche du Japon, visait à vérifier si les cellules souches embryonnaires de souris, cultivées en laboratoire, peuvent être amenées à former une structure semblable.
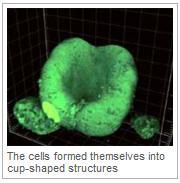
La rétine est la couche sensible à la lumière située à l'arrière de l'œil et nous permet de voir. Pendant le développement embryonnaire, les cellules qui finissent par former la rétine, forment d'abord ce qu'on appelle la vésicule optique, qui forme une structure à deux parois en forme de coupe, la coupe optique. La couche externe de la rétine se développe ensuite et comprend les cellules pigmentées et la couche interne de la rétine, qui contient les nerfs sensibles à la lumière impliqués dans la transmission des informations de l'œil au cerveau. Ce processus de développement est complexe et influencé par les tissus voisins. Les chercheurs ont voulu voir si ils pouvaient reconstituer ce processus en laboratoire et en l'absence de ces tissus voisins.
Une fois les cellules souches cultivées, les chercheurs ont examiné si ces cellules formaient des structures en trois dimensions en utilisant des microscopes spéciaux, et réalisé d'autres études pour voir quelles protéines jouaient un rôle important dans ce processus de développement. Les chercheurs ont constaté que ces cellules ont commencé à s'aligner dans les structures hémisphériques. La partie avant se pliant ensuite pour former une structure qui ressemblait à une coupe optique qui s'est ensuite transformée en une structure en couches ressemblant à une rétine normale.
Les chercheurs ont conclu qu'il est possible de reproduire la formation d'un complexe en trois dimensions des structures embryonnaires du tissu rétinien en laboratoire, et que ce processus pourrait être accompli sans les tissus voisins. Cette recherche "annonce la prochaine génération de médecine générative en thérapeutique de la dégénérescence de la rétine, et ouvre de nouvelles perspectives pour la transplantation de feuilles artificielles de tissu rétinien, plutôt que de simples greffes de cellules ».
Source:Nature, Volume 472, 51-56 [April 7 2011] “Self-organizing optic-cup morphogenesis in three-dimensional culture.” Nature News, Published online 6 April 2011“Stem cells make 'retina in a dish'.


