Tout changement est conduit par des changements d’énergie. A part peut-être dans la pensée, encore qu’il s’agisse de fluctuations énergétiques au niveau des canaux ioniques, régis par l’équation de Nernst et celle de Goldman-Hodgkin-Katz. Justement, l’équation de Nernst est celle à qui nous devons notre vie à l’heure actuelle : en vertu de cette équation, l’asymétrie de composition ionique entre l’intérieur et l’extérieur de nos cellules est à l’origine d’une différence de potentiel : c’est le potentiel électrochimique de membrane. Celui-ci est universel chez les êtres vivants et sa modification permet un potentiel d’action, c’est-à-dire n’importe quelle afférence ou efférence sensitivo-motrice (qu’il s’agisse de voir, penser ou de bouger le bras), les neurones jouant notamment le rôle de fil électrique (elles en assurent la conduction). Chez nous, ce potentiel de repos est principalement du au sodium, au potassium et au chlore, les ions Na+ et Cl- siégeant majoritairement à l’extérieur des cellules, tandis que K+ se trouve en majorité à l’intérieur.
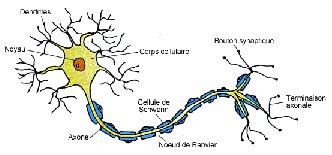
Schéma d’un neurone : le potentiel d’action naît au niveau du cône d’émergence de l’axone (on l’appelle zone gâchette).
Cette asymétrie elle-même est due à l’effet Gibbs-Donnan : une membrane semi-perméable, telle la membrane plasmique, a tendance a générer une asymétrie de composition ionique pour la bonne raison que l’électroneutralité doit se faire, or les cellules produisent des protéines, trop grosses pour traverser la membrane plasmiques. Elles s’accumulent à l’intérieur ; or certaines sont chargées négativement (protéinate), en conséquence de quoi l’équilibre physico-chimique est perturbé…
Mais tant l’équation de Nernst est primordiale, je vous propose que nous la démontrions !
La démonstration
Le prérequis est la compréhension parfaite du phénomène d’oxydoréduction : un transfert d’électrons entre un oxydant et un réducteur.
Dans une réaction électrochimique, le déplacement de particules chargées a pour conséquence une différence de potentiel, notée ΔE. Le travail électrique W (en joules) est le produit de la charge q (en coulombs) et du potentiel ΔE (en volts) :
W = q × ΔE
D’après la thermodynamique et ce qui précède, la variation réactionnelle d’enthalpie libre, ΔrG, est de :
ΔrG = −W = −q × ΔE
Le nombre d’électrons (n) dans une réaction électrochimique (oxydoréduction) est liée à la quantité de charges électriques transférée. Sachant que chaque mole d’électrons a une charge électrique de 96485 C (Constante de Faraday, F) :
q = n × F
Ainsi,
ΔrG = −n × F × ΔE
ou, à l’état standard (symbolisé par °) :
ΔrG° = −n × F × ΔE0
Prenons la réaction suivante :
aA + bB = cC + dD
Comme toute réaction d’oxydoréduction, elle est une combinaison de deux demi-réactions, et la constante d’équilibre s’écrit :
![Démonstration de l’équation de Nernst Figure indiquant la constante d'équilibre K = ([C]^c[D]^d)/([A]^a[B]^b)](http://media.paperblog.fr/i/555/5553900/demonstration-lequation-nernst-L-hMdrKT.jpeg)
Toujours d’après la thermodynamique,
ΔG = ΔG0 + RT × ln K
ou encore, en remplaçant par ce qu’on a trouvé :
−n × F × ΔE = −n × F × ΔE0 + RT × ln K
avec R la constante des gaz parfaits et T la température (en kelvins). En réécrivant la formule, on obtient :
![Démonstration de l’équation de Nernst Figure indiquant la formule E = E sup 0 - RT/nF multiplié par ln( ([C]^c[D]^d)/([A]^a[B]^b))](http://media.paperblog.fr/i/555/5553900/demonstration-lequation-nernst-L-tv7KPH.jpeg)
… et voici la formule de Nernst !
Attention cependant : E (respectivement E°) est la force électromotrice (respectivement la force électromotrice standard) d’une pile redox, définie comme la différence : E(Couple dont l’élément gagne des électrons) – E(Couple dont l’élément perd des électrons), chacun des termes étant obtenue séparément par l’équation de Nernst s’appliquant à la demi-réaction.
Pour les puristes, l’équation de Nernst s’appliquant en biologie cellulaire est légèrement différente de celle-ci, au sens où les potentiels en question ne sont pas des potentiels d’oxydoréduction (encore appelés potentiels d’électrode) mais des potentiels électrochimiques. Pour comprendre la distinction, il faut faire appel au potentiel chimique (enthalpie libre molaire partielle, c’est-à-dire dérivée partielle de l’enthalpie libre du système par rapport à la quantité de matière d’un constituant) : lorsqu’une espèce chimique est présente dans deux phases, à l’équilibre les potentiels chimiques dans chacune des phases sont égaux. Or, une membrane empêche l’égalisation des potentiels chimiques de certaines espèces, en l’occurrence entre l’intérieur et l’extérieur de la cellule. Ce phénomène est d’autant plus important qu’il s’agit d’espèces chargées (ions), d’où l’apparition d’une différence de potentiel électrique. Finalement, il y a différence de potentiel électrochimique !
A noter que le transport actif, c’est-à-dire nécessitant de l’énergie, et ne relevant pas la diffusion régie par la loi de Fick, intervient au niveau de la membrane plasmique, accentuant ou atténuant le phénomène selon qu’un stimulus excitateur ou inhibiteur est véhiculé.
Voilà donc ! Maintenant, vous savez pourquoi vous clignez des yeux

