Fin 2011, l’équipe de Ludwik Leibler (CNRS, laboratoire Matière molle et chimie / ESPCI) a mis au point un matériau aux propriétés surprenantes. Baptisé vitrimère, cette matière est similaire au caoutchouc mais présente les propriétés du verre.
Le magazine Pour la science précise : « Jusqu’ici, il n’existait pas de matériaux organiques résistants qui, une fois durcis, peuvent être refaçonnés pour prendre n’importe quelle forme voulue, à l’instar du verre. »
La vidéo du CNRS est à visionner ici : http://www.dailymotion.com/embed/video/xmd2be_un-materiau-innovant_tech
Fabrication
Elle nécessite trois ingrédients :
- des acides gras issus des sous-produits de l’industrie papetière
- de la résine époxy
- un catalyseur
Après chauffage, le mélange est versé sur une plaque et cuit dans une presse chauffante. Le procédé de synthèse est relativement simple, puisqu’il fait appel à la transestérification, réaction toute simple où un ester et un alcool sont transformés en un autre ester et un autre alcool (c’est la réaction qui, au sein de nos cellules, permet l’épissage des introns lors de la maturation des ARN messagers).
Applications potentielles
En plus d’être léger, le vitrimère est malléable à chaud, insoluble, et plus résistant que le verre. Les secteurs du bâtiment, de l’électronique, l’aéronautique, l’automobile ou encore l’imprimerie se disent déjà être intéressés par ce nouveau matériau.
Il est, selon sa composition soit élastique et mou, soit solide et dur. A l’instar d’une pâte à modeler, il est façonnable de manière réversible et à volonté, réparable et recyclable sous l’action de la chaleur. « Ces propriétés permettent notamment d’obtenir des formes d’objets qui sont difficiles ou impossibles à obtenir par moulage ou pour lesquels la réalisation d’un moule s’avère trop coûteuse pour la fabrication envisagée », précisent les chercheurs.
Le vitrimère permettrait de modifier le profil aérodynamique d’une planche de surf, d’effacer les rayures sur le capot d’une voiture en chauffant, ou encore de réparer ou souder des objets en plastique. « Utilisé comme base de composites, ce nouveau matériau pourrait ainsi favorablement concurrencer les métaux et trouver de larges applications dans des secteurs aussi divers que l’électronique, l’automobile, la construction, l’aéronautique ou l’imprimerie. » soulignent ainsi les chercheurs.

Vitrimère © CNRS/ESPCI/Cyril Frésillon
Polymérisation
En chimie, on distingue les monomères et les polymères, assemblages de monomères. Un polymère est une molécule très grosse ; parfois elle n’en finit pas (millions de monomères)…
On connaît tous le polystyrène, pour l’emballage des objets fragiles. Eh bien il s’agit d’un polymère de styrène, comme c’est le cas de tous les composés avec le préfixe “poly”.

Les molécules de polystyrène sont grosses, comparées au nomère : le styrène.
Autre exemple, le polyéthylène : on part d’une brique élémentaire, l’éthylène C2H4, assemblées par dizaine pour créer une longue chaîne : le polyéthylène :

La réaction de formation d’un polymère est est la polymérisation. Selon que les monomères sont ou non les mêmes, on parle d’homopolymère ou de copolymère. Les polymères sont à la base de la société de consommation, puisqu’ils constituent les plastiques. En plus de ceux sus-cités, on trouve :
- le polyhexaméthylène adipamidepolyamide, polyamide plus connue sous l’appellation nylon
- le PVC (polychlorure de vinyle)
- le PET (polyéthylène téréphtalate), un polyester
- le polyméthacrylate de méthyle, ou plexiglas
- le polytétrafluoroéthylène, téflon
- le polycarbonate, issu de la polycondensation (polymérisation par étapes) du bisphénol A, tristement célèbre…
Deux catégories de polymères
Ce qui est à l’origine des propriétés des plastiques (plus ou moins grande résistance, malléabilité, température de fusion, etc), c’est la façon dont, à un degré structural supérieur, les polymères sont liés entre eux pour former un édifice macroscopique. A l’instar de spaghettis, ces chaînes peuvent être plus ou moins enroulées, et les plastiques ont des propriétés très différentes selon le degré de réticulation des chaînes (polymères).
Avec le chauffage, les plastiques qui ne sont plus ou moins qu’empilement de polymères peuvent se désagréger. Le plastique fond alors : on parle de thermoplastiques.
A contrario, les polymères s’enroulant en des structures complexes ont plus de chance de former des liaisons fortes. C’est le phénomène de réticulation, ou formation de réseaux tridimensionnels, qui se ressent au niveau macroscopique : on parle alors de plastiques thermordurcis. Lorsqu’on les chauffe, les chaînes moléculaires ne pouvant coulisser, ils ne fondent pas mais se calcinent, c’est-à-dire qu’ils brûlent, jusqu’à carboniser (donner des cendres). La bakélite, le formica, la mélamine et l’époxy sont autant d’exemples.

On peut comparer la réticulation à l’enroulement des pelotes de laine avec lesquelles aime tant jouer les chatons : plus les polymères font des nœuds, plus l’édifice moléculaire est stable, donc moins le plastique a tendance à fondre.
L’étude des nœuds, même si dans le cas des plastiques c’en ne sont pas vraiment, est l’objet de la chimie supramoléculaire, qui étudie les interactions faibles au sein des matériaux, et plus particulièrement de la topochimie (voir www-chimie.u-strasbg.fr/~lcom/Recherche/topochimie3.html)
Modification chimique
Il est possible – et on ne s’en prive pas – de modifier les propriétés d’un plastique. Prenons l’exemple du caoutchouc. A l’état naturel, il s’agit d’un polymère thermoplastique, dont les chaînes ne sont pas fortement liées entre elles, donc. Par conséquent, il peut être fondu et coule si la température est suffisamment élevée.
La vulcanisation du caoutchouc consiste à ajouter du soufre et à chauffer, afin de créer des ponts entre les chaînes pour le réticuler : on obtient ainsi un matériau thermodurci. Le principe est illustré ci-dessous :
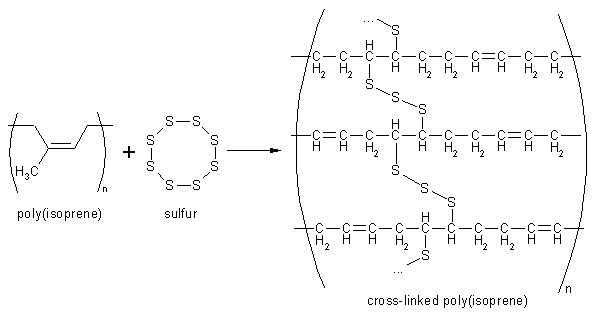
Vulcanisation du caoutchouc (polymère d’isoprène)
La vulcanisation, qui s’applique aussi au latex, est donc un procédé fort ingénieux ! Elle fut découverte par hasard par l’Américain Charles Goodyear en 1839, lors de la chute d’un morceau de caoutchouc traité au souffre sur un poêle. “Découverte” et non inventée, car elle est mise à jour et non pensée, d’autant qu’un phénomène semblable assure la cohésion de certaines protéines : les ponts disulfure.
Goodyear eut néanmoins des précurseurs : les articles caoutchoutés acquirent une grande popularité au XIXème siècle, mais ils devenaient cassants par temps froid, et collants et nauséabonds par temps chaud. En 1834, les chimistes allemand Friedrich Ludersdorf et américain Nathaniel Hayward découvrirent que l’addition de soufre à la gomme de caoutchouc diminuait ou même éliminait la nature collante des produits finis. D’autre part, l’Anglais Thomas Hancock aurait découvert de son côté la vulcanisation, procédé sans lequel notre civilisation ne serait pas ce qu’elle est…
L’idéal : un matériau thermoplastique et thermoducissable
Grâce à la présence des liaisons fortes qui réticulent les chaînes, les polymères thermodurcis ont des performances beaucoup plus intéressantes que les thermoplastiques, notamment concernant leur comportement mécanique et leur stabilité thermique ou chimique. Ils sont donc utilisés dans les applications les plus exigeantes, comme l’industrie des biomatériaux, aérospatiale ou automobile.
Bien qu’ils soient moins performants que les thermodurcis, les thermoplastiques possèdent un avantage : ils ramollissent quand la température augmente. Ceci permet de les mouler ou de modifier leur forme à volonté, mais aussi de les recycler : ils sont fondus, puis reformés.
C’est justement le défaut de leurs cousins thermodurcis : une fois qu’on les a réticulés, impossible de changer leur forme. Impossibles à recycler, on ne peut les produire qu’une seule fois : ils acquièrent dans le moule leur forme définitive.
Or les chercheurs ont réussi un exploit avec le vitrimère : créer un plastique aussi performant que les thermodurcis, mais malléable à souhait, comme les thermoplastiques : le vitrimère est réticulé, mais ramollit pourtant quand on augmente sa température.
Une propriété intéressante de ces nouveau plastique concerne l’évolution de sa viscosité avec la température. S’agissant d’un matériau proche du verre, on définit la température de transition vitreuse comme le seuil (conventionnel) à partir duquel la viscosité devient suffisamment faible pour qu’on puisse le déformer.
Dans le cas du verre, la viscosité varie de manière relativement régulière quand on approche la température de transition vitreuse ; il n’y a guère besoin de contrôler finement la température pour travailler le verre : c’est ce qui permet au souffleurs d’exercer leur métier.
En revanche, pour les thermoplastiques classiques, la variation de viscosité est assez abrupte. Or le vitrimère, grâce à des liaisons reconfigurables, a un comportement bien plus proche de celui du verre que du plastique. Pas besoin de contrôler finement la température ; c’est pourquoi les chercheurs utilisent un sèche-cheveux dans leur vidéo !
Explication du phénomène
La prouesse des chercheurs tient au fait que ce nouveau matériau a des propriétés en commun avec le silicium. le titre de leur publication dans Science Magazine est d’ailleurs “Silica-Like Malleable Materials from Permanent Organic Networks“. Le résumé est consultable ici : http://www.sciencemag.org/content/334/6058/965.short.
L’idée maîtresse qui a guidé les chercheurs fut de concevoir une structure telle qu’à haute température il existe des échanges de liaisons permettant un relâchement des tensions et donc la malléabilité tandis qu’au refroidissement ces échanges deviennent si lents que le système se comporte comme un solide. Cette structure en réseau peut maintenir son intégrité à haute température car, en dehors des échanges de liaisons, il n’y a pas rupture de liaisons, donc pas de dépolymérisation.
C’est en faisant polymériser des résines époxy avec un catalyseur à base de zinc qu’on obtient des solides thermoplastiques qui présentent, une fois refroidis, des propriétés mécaniques et d’insolubilité analogues à celles de la silice, constituant principal du verre.
En partant d’une résine époxy standard, un élastomère, polymère élastique est obtenu, et un dispositif permettant de le façonner en torsade par chauffage.

Le vitrimère chauffé est torsadé au moyen de ce drôle d’appareil. © CNRS/ESPCI/Cyril Frésillon
Des échantillons cassés ou réduits en poudres peuvent être reconstitués par moulage à chaud à la presse à injection : le matériau est recyclable. Grâce à des liaisons particulières, il est également insoluble dans un solvant aussi puissant que le trichlorobenzène. Mais surtout, de même que les métaux avec un fer à souder, on peut le souder sans apport de substance :
Soudure obtenue par pressage à chaud de deux bandes de vitrimère de couleur différente. Les deux pièces sont unies par des liaisons chimiques, simplement ! © CNRS/ESPCI/Cyril Frésillon
En partant d’ une résine époxy légèrement différente, les chercheurs ont aussi obtenu un matériau, aussi insoluble que le précédent, qui ne se dépolymérise pas non plus à haute température mais qui se comporte à température ambiante comme une résine époxy classique dure thermodurcissable. En revanche, à la différence des thermodurcissables classiques, le matériau est déformable à 200° C et, si on le réduit en poudre, il est reconstituable par moulage à 240°C. Il est donc aussi recyclable.Le vitrimère récompensés
Le vitrimère a été nommé Best Chemistry 2011 par l’hebdomadaire Chemical & Engineering News de l’American Chemical Society, tant l’innovation est grande. D’autant que la conception de matériaux réutilisables est un enjeu à la fois économique et écologique, comme le précise l’ESPCI (Ecole Supérieure de Physique et de Chimie Industrielles, Paris) dans son communiqué. La malléabilité à chaud est une propriété dont on pensait qu’elle était l’apanage du verre (silicium), et non des composés issus de la chimie organique, c’est-à-dire comportant une large proportion de carbone, hydrogène, oxygène et azote, et potentiellement synthétisables par les êtres vivants. Certes, on n’en est plus à se poser des questions sur le vitalisme, comme ce fut le cas lors de la synthèse de l’urée par Wöhler en 1828, mais cette prouesse montre que la chimie organique n’a pas dit son dernier mot…
48.856667 2.350987