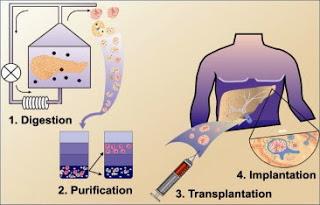
Principales étapes d'isolement d'îlots pancréatiques humains. Pour utilisation en thérapie du diabète de type 1. In Médecine Nucléaire Volume 34, Issue 10, October 2010, Pages 589 - 596
Source iconographique et légendaire: http://www.sciencedirect.com/science/article/pii/S0928125810002172
Cette étude était un essai monocentrique de phase 1 / 2. 24 patients adultes (18 – 55 ans) atteints d’un diabète de type 1 insulino — dépendant patent et porteurs d’au moins d’un autoanticorps lié au diabète ont été recrutés et répartis de manière aléatoire (ratio 1 :1 :1 :1 ; liste de randomisation générée par ordinateur en blocs de 4) pour recevoir le placebo ou IL2 à raison de 0,33 MIU / jour, ou 1 MIU / jour ou 3 MIU / jour sur une session de 5 jours ; les patients ont été suivis sur une durée de 60 jours. Ni les investigateurs ni les participants n’avaient accès au tableau de randomisation. Le critère principal mesuré était le changement en [Treg] , mesuré par cytométrie, et exprimé en pourcentage de cellules T CD4+, du jour 1 au jour 60. (…).
Six patients ont été assignés à chaque groupe entre le 1er juin 2011 et le 3 février 2012. IL2 a été bien toléré à toutes les doses administrées, sans événements indésirables graves. Cependant , une association dose – réponse a été notée concernant les événements indésirables non graves, pendant la phase de traitement (jours 1-6) ; un patient dans le groupe placebo, trois patients dans le groupe 0,33 MIU, cinq patients dans le groupe 1 MIU, et six patients dans le groupe 3 MIU ont montré des événements indésirables non graves. Les événements indésirables les plus communs dans la phase de traitement étaient des réactions à l’injection (aucun patient placebo versus trois patients avec 0,33 MIU et 1 MIU versus deux patients avec 3 MIU), des syndromes de type grippal (aucun patient placebo versus un patient avec 0,33 MIU et 1 MIU versusquatre patients avec 3 MIU). Après la phase de traitement, les événements indésirables n’ont pas montré de différence entre les groupes. IL2 n’a pas induit de changements délétaires pour ce qui est des paramètres liés au métabolisme du glucose. IL2 a provoqué une augmentation dose dépendante dans la proportion de cellules Treg, significative à toutes les doses en comparaison du placebo (augmentation moyenne chez les placebo 0,5% [Déviation Standard (SD) 0,4] ; 0,33 MIU 2,8% [1,2] ; p=0,0039 ; 1 MIU 3,9% [1,8] ; p=0,0039 ; 3 MIU 4,8% [1,9] ; p=0,0039).
Nous avons défini une dose d’IL2 à la fois bien tolérée et efficace sur le plan immunitaire à appliquer en thérapie et prévention du diabète de type 1, qui pourrait être pertinente pour utilisation dans le traitement d’autres troubles pour lesquels une augmentation des cellules Treg serait souhaitable. Prof Agnès Hartemann et al, dans The Lancet Diabetes & Endocrinology, publication en ligne en avant – première, 8 octobre 2013
Financement : Assistance Publique-Hôpitaux de Paris, INSERM, et Université Pierre et Marie Curie
Source : The Lancet Online / Traduction et adaptation : NZ
