#Cell #vieillissement #vertébrés #télomères #telomerase Plateforme d’Exploration Rapide du Vieillissement et des Maladies chez les Vertébrés à Courte Durée de Vie
Publié le 13 février 2015 par Tartempion77
@NZarjevski
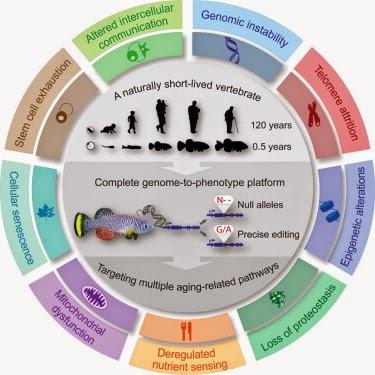
Genomic instability = instabilité génomique
Telomere attrition = attrition des télomères
Epigenetic alterations = altérations épigénétiques
Loss of proteostasis = Perte du controle de la protéostase
Deregulated nutrient sensing = altération de la sensibilité au nutrients par capteur intrinsèque
Mitochondrial dysfunction = dysfonction mitochondriale
Cellular senescence = sénéscence cellulaire
Stem cell exhaustion = épuisement des cellules souches
Altered intercellular communication = altération de la communication intercellulaire
Le vieillissement est le facteur de risque N°1 pour de nombreuses maladies, il reste toutefois difficile d'étudier cela sur des modèles de vertébrés à longue durée de vie. Le développement d'une plateforme intégrative "du génome au phénotype" sur modèle de vertébré à courte durée de vie, le fondule barré à lignes turquoises*, ouvre la voie à la modélisation à haute efficacité du vieillissement et des maladies humaines complexes.
Source iconographique et légendaire: http://www.sciencedirect.com/science/journal/aip/00928674
Le vieillissement est un processus complexe affectant de multiples organes. La modélisation du vieillissement et des pathologies associées à l’âge en laboratoire reste un défi à relever, parce que les modèles classiques de vertébrés ont une longue durée de vie. Ici, nous développons la première plateforme d’exploration rapide des caractéristiques et pathologies dépendant de l’âge chez les vertébrés, utilisant le fondule barré* africain à lignes turquoises. Nous fournissons ce faisant une boîte à outils d’exploration et de manipulation du génome chez cet organisme, utilisant notre technologie CRISPR/Cas9 d’assemblage génomique de novo. Nous provoquons un grand nombre de gènes englobant les étapes de processus de vieillissement, et produisons des lignées cellulaires stables dans les 2-3 mois sur un échantillon d’entre eux. Nous montrons- en guise de preuve de principe - que le poisson déficient pour telle ou telle sous-unité de télomérase montre, de fait, le déclenchement le plus rapide de pathologies liées aux télomères chez les vertébrés. Nous démontrons par ailleurs la faisabilité de fabrication de variants génétiques spécifiques. Cette plateforme « du génome au phénotype » représente une source unique d’étude du vieillissement et des pathologies à haute efficacité chez les vertébrés, ainsi que pour l’investigation relative aux gènes candidat qui se dégagent, lors des études sur génome entier. Itamar Harel et al, dans Cell, publication en ligne en avant-première, 12 février 2015*petit poisson (longueur maximale = 10 cm)Contributeurs : National Institute of Health (USA), Glenn Laboratories for the Biology of Aging
Source:
Science Direct / Traduction et adaptation: NZ

