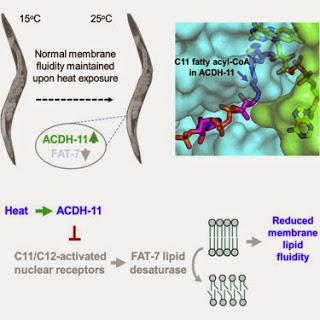
Les cellules ont la nécessité d'ajuster les niveaux de lipides saturés pour le maintien de la fluidité membranaire suite à un changement de température. Un métabolisme des protéines très conservé relie ces processus chez C.elegans par la séquestration des acides gras de l'activateur transcriptionnel de la lipide désaturase lors d'une élévation de la température.
Les cellules s’adaptent aux changements de température par ajustement de la désaturation des lipides et de la fluidité membranaire. Ce processus fondamental survient dans presque toutes les formes de vie, mais son mécanisme reste inconnu chez les eucaryotes. Nous avons découvert que le gène très conservé sur le plan évolutif acdh-11(acyl-CoA déhydrogénase[ACDH]) chez Caenorhabditis elegans est facilitateur de l’adaptation à la chaleur par la régulation de l’enzyme lipide désaturase FAT-7. La déficience en ACDH humaine est à l’origine des troubles héréditaires de l’oxydation des acides gras le plus commun, à savoir les syndromes exacerbés par l’hyperthermie. La chaleur provoque une régulation à la hausse de l’expression de acdh-11pour diminuer celle de fat-7. Nous avons décrypté la structure la structure de ACDH-11 et établi la base moléculaire de sa haute affinité de liaison aux chaînes d’acides gras C11/C12. ACDH-11 séquestre les chaînes d’acides gras C11/C12 et bloque ce faisant l’activation des récepteurs nucléaires aux hormones ainsi que la l’expression régulée de fat-7. Ainsi, la voie de signalisation ACDH-11 contrôle l’adaptation à la chaleur par la liaison des changements de température à la régulation des niveaux de lipide désaturase et de la fluidité membranaire par le truchement d’un mode de signalisation des acides gras inédit. Denke K. Ma et al, dans Cell, publication en ligne en avant-première, 14 mai 2015Source iconographique, légendaire et rédactionnelle: Science Direct / Traduction et adaptation : NZ
