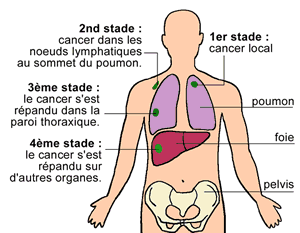
Au stade 4, le cancer du poumon primaire a produit des métastases.
Source iconographique: http://www.doctissimo.fr/html/sante/principalespatho/sa_121_cancer_trait.htm
Nous avons effectué cette étude ouverte et randomisée de phase 3 dans 184 sites d’investigation situés dans 26 pays. Les patients âgés de 18 ans ou plus, atteints de cancer du poumon non à petites cellules squameux de stade IV confirmé par histologie ou par cytologie, présentant un statut de rendement ECOG (Eastern Cooperative Oncology Group) de 0-2 et une fonction adéquate des organes - n’ayant reçu aucun traitement de chimiothérapie au préalable pour cette maladie - étaient éligibles pour inclusions dans cette étude. Les patients recrutés ont été répartis par système centralisé et de manière aléatoire (1:1) pour recevoir un maximum de six cycles de 3 semaines de chimiothérapie à base de gemcitabine et cisplatine avec ou sans necitumumab selon un schéma de randomisation par blocs (taille de bloc = 4) réalisé à l’aide d’un système interactif vocal (téléphone) ou internet (web). La chimiothérapie était constituée de gemcitabine 1205 mg/m2administrée par voie intraveineuse sur une période 30 minutes aux jours 1 et 8 de chaque cycle de 3 semaines et de cisplatine 75 mg/m2 administrée par voie intraveineuse sur une période de 120 minutes au jour 1 de chaque cycle de 3 semaines. Le necitumumab 800 mg, administré par voie intraveineuse pendant 50 minutes au minium aux jours 1 et 8 était poursuivi après la fin de la période de chimiothérapie, jusqu’à progression de la maladie ou occurrence d’effets toxiques intolérables. La randomisation était stratifiée selon le statut de rendement ECOG et la région géographique. À la fois les médecins et les patients avaient accès au tableau de randomisation du fait de la survenance prévue d’éruptions de type acnéique - un effet de classe des anticorps EFGR - qui aurait levé de facto l’insu des traitements à la fois chez les patients et chez les investigateurs. Le critère principal était la survie globale, analysée sur population en intention de traiter. Le présent rapport est le rapport final d’analyse clinique de cet essai. (…).
Entre le 7 janvier 2010 et le 22 février 2012, nous avons recruté 1 093 patients et les avons répartis de manière aléatoire pour recevoir necitumumab plus gemcitabine et cisplatine (n=545) ou gemcitabine et cisplatine (n=548). La survie globale était significativement plus longue dans le groupe necitumumab plus gemcitabine et cisplatine que dans le groupe gemcitabine plus cisplatine seules (médiane de 11.5 mois [Intervalle de Confiance -IC- 95% 10.4-12.6]) versus 9.9 mois [8.9-11.1] ; hazard ratio stratifié 0.84 [IC 95% 0.74-0.96 ; p=0.01]). Dans le groupe necitumumab plus gemcitabine et cisplatine, le nombre de patients présentant au moins un événement indésirable de grade 3 était plus élevé dans le groupe necitumumab plus gemcitabine et cisplatine (388 [72%] patients sur 538) que dans le groupe gemcitabine et cisplatine (333 [62%] patients sur 541); comme l’était l’incidence des événements indésirables graves (257 [48%] patients sur 538 versus 203 [38%] patients sur 541). Un nombre plus élevé de patients sous necitumumab plus gemcitabine et cisplatine ont présenté des hypomagnésémies de grade 3-4 (47 [9%] patients sur 538 dans le groupe necitumumab plus gemcitabine et cisplatine versus six [1%] patients sur 541 dans le groupe gemcitabine et cisplatine) ainsi que des éruptions cutanées de grade 3 (20 [4%] versus un [<1%]). Les événements indésirables ayant le décès du sujet pour issue - événements indésirables liés à la progression de la maladie inclus - ont été rapportés chez 66 (12%) patients sur 538 patients du groupe necitumumab plus gemcitabine et cisplatine et 57 (11%) patients sur 541 du groupe gemcitabine plus cisplatine ; ces événements ont été présumés reliés aux médicaments à l’étude chez 15 (3%) et dix (2%) patients, respectivement. Dans l’ensemble, nous avons trouvé que le profil de sécurité relevé dans le groupe necitumumab plus gemcitabine et cisplatine était acceptable et en ligne avec les prévisions.
Nos résultats montrent que l’adjonction de necitumumab à la chimiothérapie à base de gemcitabine et cisplatine améliore la survie globale chez les patients atteints de cancer du poumon non à petites cellules squameux avancé et représente une nouvelle option de traitement de première intention de cette maladie. Prof Nick Thatcher, FRCP, et al, dans The Lancet Oncology, publication en ligne en avant-première, 1er juin 2015
Financement : Eli Lilly and Company
Source : The Lancet Online / Traduction et adaptation : NZ
