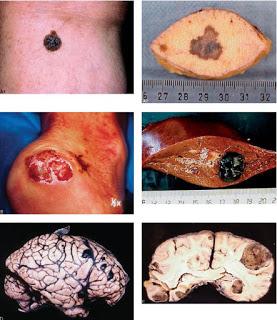
A1. Aspect macroscopique tumeur noire à contours irréguliers, polychrome.A2. Exérèse cutané d’un mélanome (noter la présence d’un petit naevus naevo cellulaire à l’extrémité gauche du fragment cutané).B. Mélanome achromique de la cheville à un stade avancé (type acro-lentigineux).C. Métastase hépatique.D et E. Métastases cérébrales d’un mélanome.Source iconographique et légendaire: http://campus.cerimes.fr/anatomie-pathologique/enseignement/anapath_11/site/html/1.html
Il n’existe que peu d’options de rechange pour des patients atteints de mélanome en progression sous ipilimumab, et, s’ils sont positifs pour la mutation BRAFV600, en progression sous inhibiteurs du gène BRAF ou MEK ou des deux -. Nous avons étudié l’efficacité et la sécurité de deux doses de pembrolizumab versus chimiothérapie au choix de l’investigateur chez des patients atteints de mélanome réfractaire à l’ipilimumab.Nous avons effectué un essai de phase 2 randomisé chez des patients âgés de 18 ans ou plus dans 73 hôpitaux, cliniques ou centres médicaux universitaires situés dans 12 pays, qui présentaient une maladie à progression confirmée dans les 24 semaines suivant l’administration de deux doses ou plus d’ipilimumab et, s’ils étaient positifs pour la mutation BRAFV600, également à progression confirmée sous traitement avec un inhibiteur de BRAF ou de MEK ou des deux gènes. Les patients devaient avoir résolu tous les évènements indésirables de grade 0 ou de grade 1 dus à l’ipilimumab, devaient être sous prednisone (10 mg/jour ou moins) depuis au moins deux semaines, devaient présenter un statut de rendement ECOG (Eastern Cooperative Oncology Group) de 0 ou 1, et devaient présenter au moins une lésion mesurable pour être éligibles. À l’aide d’un système vocal interactif, nous avons effectué la randomisation des patients (1:1:1) par blocs de 6 pour recevoir pembrolizumab 2 mg/kg ou 10 mg/kg par voie intraveineuse toutes les 3 semaines oula chimiothérapie au choix de l’investigateur (paclitaxel + carboplatine, paclitaxel, carboplatine, dacarbazine, ou temozolomide par voie orale). La randomisation était stratifiée selon le statut de performance ECOG, la concentration en lactate déshydrogénase, et le statut de mutation BRAFV600. L’assignation des traitements sur un plan individuel (entre pembrolizumab et la chimiothérapie) était effectuée en ouvert, mais ni les investigateurs ni les patients n’avaient accès à la dose de pembrolizumab administrée. Nous présentons le critère principal d’évaluation dans le cadre de la deuxième analyse intermédiaire, à savoir la survie sans progression de la maladie sur la population en intention de traiter (…).
Entre le 30 novembre 2012 et le 13 novembre 2013, nous avons recruté 540 patients : 180 patients ont été répartis de manière aléatoire pour recevoir pembrolizumab 2 mg/kg, 181 pour recevoir pembrolizumab 10 mg/kg, et 179 pour recevoir la chimiothérapie. Sur la base de 410 évènements sans progression de la maladie constatés, la survie sans progression était améliorée chez les patients recevant le pembrolizumab 2 mg/kg (Hasard Ratio [HR] 0.57, Intervalle de Confiance [IC] 95% 0.45-0.73 ; p<0.0001) et chez ceux recevant le pembrolizumab 10 mg/kg (0.50, 0.39-0.64 ; p<0.0001) en comparaison des patients recevant la chimiothérapie. La survie sans progression à 6 mois était de 34% (IC 95% 27-41) dans le groupe pembrolizumab 2 mg/kg, 38% (31-45) dans le groupe 10 mg/kg, et de 16% (10-22) dans le groupe chimiothérapie. Les évènements indésirables de grade 3-4 liés au traitement sont survenus chez 20 (11%) patients dans le groupe pembrolizumab 2 mg/kg, 25 (14%) dans le groupe pembrolizumab 10 mg/kg, et 45 (26%) dans le groupe chimiothérapie. L’évènement indésirable de grade 3-4 lié au traitement le plus commun était fatigue (deux [1%] patients sur 178 dans le groupe 2 mg/kg et un [<1%] patient sur 179 dans le groupe 10 mg/kg, comparé à huit [5%] patients sur 171 dans le groupe chimiothérapie). D’autres évènements indésirables de grade 3-4 liés au traitement incluaient œdème généralisé et myalgie (deux [1%] patients pour chaque évènement) chez les patients recevant pembrolizumab 2mg/kg ; hypopituitarisme, colite, diarrhée, diminution de l’appétit, hyponatrémie, et pneumonie (deux [%] patients pour chaque évènement) chez les patients recevant pembrolizumab 10 mg/kg ; anémie (neuf [5%]), fatigue (huit [5%]), neutropénie (six [4%]), et leucopénie (six [4%]) chez ceux recevant la chimiothérapie.
Ces résultats hissent le pembrolizumab au rang de nouveau soin standard pour le traitement du mélanome réfractaire à l’ipilimumab. Prof Antoni Ribas MD, et al, dans The Lancet Oncology, publication en ligne en avant-première, 23 juin 2015
Financement : Merck Sharp & Dohme
Source : The Lancet Online / Traduction et adaptation : NZ
