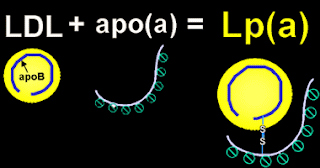
Source iconographique: http://www.med.yamanashi.ac.jp/clinical_basic/pathol01/naiyo_apo_a.html
La lipoprotéine(a) (Lp[a]) représente un facteur de risque de maladie cardiovasculaire et de sténose valvulaire aortique. Il n’existe à ce jour aucun traitement efficace permettant d’abaisser la Lp(a) plasmatique. Nous avons étudié l’innocuité, la pharmacocinétique et la pharmacodynamique de l’ISIS-APO(a)Rx, un médicament antisens de deuxième génération visant à diminuer la synthèse d’apolipoprotéine(a) (apo[a]) dans le foie.Dans cette étude randomisée de phase 1, en double aveugle contrôlée par placebo mise en œuvre à la l’Unité de Recherche Clinique en Pharmacologie PAREXEL (Harrow, Middlesex, Royaume - Uni), nous avons dépisté des adultes âgés de 18 à 65 ans, présentant un Indice de Masse Corporelle (IMC) inférieur à 32.0 mg/m2, et une concentration en Lp(a) de 25 nmpol/L (100 mg/L) ou plus. À l’aide d’une technique de randomisation, nous avons réparti de manière aléatoire les participants afin qu’ils reçoivent [une injection unique de ISIS-APO(a)Rx par voie sous-cutanée (50 mg, 100 mg, 200 mg, ou 400 mg) ou le placebo (3:1) au cours de la période monodose de l’étude] ou [six injections de ISIS-APO(a)Rx (100 mg, 200 mg, ou 300 mg, pour une exposition totale réalisée de 600 mg, 1200 mg, ou 1600 mg respectivement de médicament à l’étude) ou le placebo (4:1)] pendant une période de 4 semaines, au cours de la période multi-dose de l’étude. Ni les participants, ni les investigateurs, ni le personnel de l’étude n’avaient accès au tableau de randomisation, excepté le pharmacien ayant préparé ISIS-APO(a)Rxet le placebo. Le critère principal de mesure d’efficacité était le pourcentage de changement de concentration en Lp(a) par rapport à la ligne de base, à 30 jours dans les cohortes monodoses et à 36 jours dans les cohortes multi-doses. L’innocuité et la tolérance était évaluées une semaine après administration de la dernière dose, et incluait la détermination de l’incidence, de la sévérité, et des doses administrées liées aux événements indésirables relevés et aux changements en termes de variables de laboratoire incluant profil lipidique, hématologie de routine, chimie sanguine, analyses d’urine, coagulation et variables complémentaires. Les autres mesures effectuées comprenaient signes vitaux, examen physique, et électrocardiogramme à 12 dérivations. (…).
Entre le 27 février 2013 et le 15 juillet 2013, 47 (23%) des 206 volontaires dépistés ont été répartis de manière aléatoire pour recevoir ISIS-APO(a)Rxen dose unique ou en multi-dose en concentration croissante ou le placebo. Dans l’étude à dose unique, nous avons réparti 3 participants pour recevoir 50 mg d’ISIS-APO(a)Rx 3 participants pour recevoir 100 mg d’ISIS-APO(a)Rx, 3 participants pour recevoir 200 mg d’ISIS-APO(a)Rx, 3 participants pour recevoir 400 mg d’ISIS-APO(a)Rx, et 4 participants pour recevoir le placebo. Tous les 16 participants ont reçu la totalité du traitement et participé au suivi de l’étude jusqu’à son terme, et ont ce faisant été inclus dans les analyses de pharmacodynamique, de pharmacocinétique et d’innocuité. En ce qui concerne la partie multidose de l’étude, nous avons réparti 8 participants pour recevoir six doses de 100 mg d’ISIS-APO(a)Rx, 9 participants pour recevoir six doses de 200 mg d’ISIS-APO(a)Rx, 8 participants pour recevoir six doses de 300 mg d’ISIS-APO(a)Rx, et 6 participants pour recevoir six doses de placebo. Alors que l’administration à dose unique d’ISIS-APO(a)Rx (50-400 mg) n’a pas provoqué de diminution des concentrations en Lp(a) au jour 30, six doses d’ISIS-APO(a)Rx(100-300 mg) ont eu pour résultat une diminution dose-dépendante moyenne des concentrations en Lp(a) par rapport à la ligne de base de 39.6% dans le groupe 100 mg (p=0.005), de 59.0% dans le groupe 200 mg (p=0.001), et de 77.8% dans le groupe 300 mg (p=0.001). Des diminutions similaires ont été observées en termes de phospholipides oxydés associés à l’apolipoprotéine B-100 et l’apolipoprotéine(a). L’événement indésirable le plus fréquemment observé était réaction modérée au site injection.
ISIS-APO(a)Rx a eu pour résultat une réduction nette, dose-dépendante et sélective en Lp(a) plasmatique. Les profils d’innocuité et de tolérance encouragent à la poursuite du développement clinique d’ISIS-APO(a)Rx comme médicament à potentiel thérapeutique visant à réduire le risque de maladie cardiovasculaire et de sténose valvulaire aortique chez des patients présentant des concentrations élevées en Lp(a). Prof Sotirios Tsimikas, MD, et al, dans The Lancet, publication en ligne en avant-première, 22 juillet 2015
Financement : Isis Pharmaceuticals.
Source : The Lancet Online / Traduction et adaptation : NZ
