 Cette nouvelle molécule identifiée par une équipe de chercheurs de l’Université de Zurich et de l’Université de Lyon serait capable de bloquer les agents infectieux responsables de l’encéphalopathie spongiforme bovine (ESB) ou maladie de la vache folle, une maladie jusque-là incurable. Présenté dans la revue Science Translational Medicine, ce candidat antiprions, qui fait ses preuves ici sur la souris, représente une percée dans la lutte contre les encéphalopathies spongiformes transmissibles.
Cette nouvelle molécule identifiée par une équipe de chercheurs de l’Université de Zurich et de l’Université de Lyon serait capable de bloquer les agents infectieux responsables de l’encéphalopathie spongiforme bovine (ESB) ou maladie de la vache folle, une maladie jusque-là incurable. Présenté dans la revue Science Translational Medicine, ce candidat antiprions, qui fait ses preuves ici sur la souris, représente une percée dans la lutte contre les encéphalopathies spongiformes transmissibles.
Les maladies à prions ou encéphalopathies spongiformes transmissibles comprennent l’encéphalopathie spongiforme bovine (« vache folle ») chez l’animal, la maladie de Creutzfeldt-Jakob chez l’Homme, ou encore le Kuru, la maladie à prions des cannibales,(ainsi que la tremblante du mouton et l’encéphalopathie des cervidés chez les cerfs et les wapitis). Ces protéines peuvent être transmises par certains types de contact avec les tissus infectés, les fluides corporels et les instruments médicaux contaminés. En effet, contrairement à la plupart des infections, causées par des bactéries, des virus ou des parasites, les maladies à prions sont liées au dysfonctionnement d’une protéine naturelle intrinsèque qui peut se convertir en protéine anormale, en raison de l’entrée de prions infectieux. Une fois dans l’organisme, le prion infectieux entraîne le mauvais repliement des autres protéines qui s’agglutinent en plaques dans le cerveau et le système nerveux formant de longues chaînes toxiques pour les neurones.
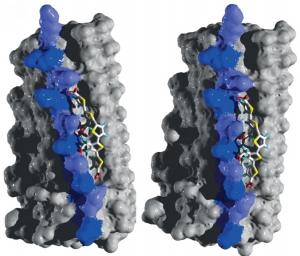
Le nom de ce candidat médicament, polythiophène. Son principe, bloquer les agrégats de prions » mal repliés « , impliqués. Les chercheurs franco-suisses ont utilisé des techniques de modélisation structurelle pour identifier des molécules à forte affinité et pouvant se lier avec ces agrégats de protéines (voir visuel ci-contre, avec la liaison en violet). Une fois arrimé, le composé polythiophène bloque le processus de réplication. Testé sur des souris et des hamsters traités, infectés par le prion, il réduit ainsi le nombre d’agrégats, stabilise ceux déjà formés en bloquant leur réplication. Au final, le candidat prolonge la survie des animaux infectés de plus de 80%.
Rappelons le dernier bilan de l’Institut de veille sanitaire (2014), soit plus de 300 cas confirmés d’encéphalopathies subaiguës spongiformes transmissibles (ESST) humaines, pour les années 2009 et 2010, en France. Précisément 312 cas et 312 décès, dont une majorité de cas de MJC sporadique une forme de cause toujours inconnue, et 2 cas de la variante de MCJ (vMJC), la forme liée à l’encéphalopathie spongiforme bovine (ESB).
Source: Science Translational Medicine 05 Aug 2015 DOI: 10.1126/scitranslmed.aab1923 Structure-based drug design identifies polythiophenes as antiprion compounds(Visuel@Herrmann et al Science Translational Medicine, 2015)


