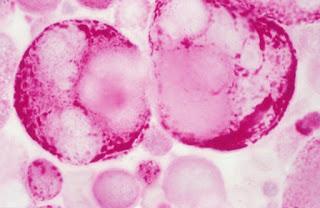
Ovaire. Epanchement péritonéal. Métastase tumorale dans l'ovaire. Coloration PAS. x100
Source iconographique et légendaire: http://www.inserm.fr/actualites/rubriques/actualites-recherche/cancers-de-l-ovaire-predire-l-agressivite-tumorale-et-la-reponse-au-traitement
Dans cet essai de phase 3 en double-aveugle, des patientes n’ayant pas reçu de chimiothérapie au préalable (âgées de 18 ans ou plus) atteintes d’un cancer de l’ovaire de stade IIB-IV selon l’échelle de la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) et venant de subir une réduction chirurgicale tumorale optimale, ont été stratifiées en fonction du statut des marges de résection, du stade FIGO de la tumeur, et de la dose planifiée d’administration de carboplatine. Les patientes ont été réparties de manière aléatoire (2:1) à l’aide d’un système interactif de réponse vocale ou de réponse par internet pour recevoir six cycles de carboplatine (Aire Sous la Courbe - AUC - 5 mg/mL par min. ou 6 mg/mL par min.) et paclitaxel (175 mg / m2) ajoutés à soit 200 mg de nintedanib (groupe nintedanib) ouplacebo (groupe placebo) deux fois par jour aux jours 2-21 de chaque période de 3 semaines pendant 120 semaines au maximum. Ni les patientes, ni les investigateurs, ni les radiologues examinateurs indépendants, n’avaient accès au tableau de randomisation. Le critère principal d’évaluation était la survie sans progression de la maladie (…) analysée sur population de traiter. (…).
Entre le 9 décembre 2009 et le 27 juillet 2011, 1 503 patientes ont été examinées et 1 366 d’entre elles réparties de manière aléatoire par neuf groupes d’étude dans 22 pays : 911 dans le groupe nintedanib et 455 dans le groupe placebo. 486 (53%) patientes sur 911 du groupe nintedanib ont présenté une progression de la maladie ou sont décédées, en comparaison des 266 (58%) patientes sur 455 du groupe placebo. La survie sans progression de la maladie était significativement plus longue dans le groupe nintedanib que dans le groupe placebo (17. 2 mois [Intervalle de Confiance -IC- 95% 16.6-19.9] versus16.6 mois [13.9 – 19.1] ; hazard ratio 0.84 [IC 95% 0.72-0.98] ; p = 0.024).Les événements indésirables les plus communément relevés étaient gastrointestinaux (diarrhée : groupe nintedanib 191 [21%] sur 902 de grade 3 et 72 [16%] de grade 4 [<1%] versus groupe placebo neuf [2%] sur 450, de grade 3 seulement) et hématologiques (neutropénie : groupe nintedanib 180 [20%] de grade 3 et 200 [22%] de grade 4 versusgroupe placebo 90 [20%] de grade 3 et 72 [16%] de grade 4 ; thrombocytopénie : 105 [12%] et 55 [6%] versus 21 [5%] et huit [2%] ; anémie : 108 [12%] et 13 [1%] versus 26 [6%] et cinq [1%]).Des événements indésirables graves ont été relevés chez 376 (42%) patientes sur 902 dans le groupe nintendanib et 155 (34%) patientes sur 450 dans le groupe placebo. 29 (3%) patientes sur 902 du groupe nintedanib versus 16 (4%) du groupe placebo patientes sont décédées en rapport avec un événement indésirables grave; 12 (1%) du groupe nintedanib et six (1%) du groupe placebo présentaient une néoplasie maligne en progression classée comme événement indésirable par l’investigateur. Des événements indésirables liés au médicament à l’étude menant à un décès sont survenus chez trois patientes du groupe nintedanib (une patiente décédée sans cause diagnostiquée ; une patiente décédée du fait d’une une septicémie d’origine indépendante au traitement, ayant pour origine diarrhée et insuffisance rénale liées au médicament à l’étude ; et un décès dû à une péritonite) et une patiente décédée dans le groupe placebo sans cause de décès définie.
Le nintedanib en combinaison avec le carboplatine et le paclitaxel représente un traitement de première intention actif, permettant une amélioration significative de la survie sans progression de la maladie chez les femmes atteintes de cancer de l’ovaire avancé ; toutefois, ce traitement est associé à un nombre plus élevé d’événements indésirables gastrointestinaux. Les futures études à entreprendre devront se focaliser sur la sélection des patientes et l’optimisation de la tolérance au traitement. Prof Andrea Du Bois, MD, dans The Lancet Oncology, publication en ligne en avant-première, 15 novembre 2015
Financement : Boehringer Ingelheim
Source : The Lancet Online/ Traduction et adaptation : NZ
