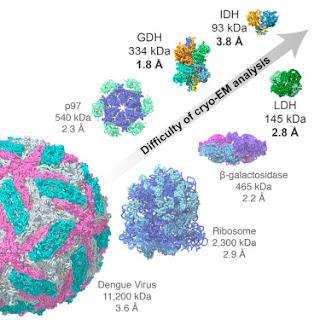
En utilisant des méthodes de cryo-EM, la structure d’enzymes métaboliques de petite taille de même que la localisation d’inhibiteurs de petites molécules qui se lient à eux peuvent être déterminée par une résolution quasi-atomique.
Les récentes avancées en microscopie cryo-électronique (cryo-EM) de particule unique permettent la génération de la résolution de structures au niveau atomique, ou presque, pour ce qui est de complexes protéiques bien ordonnés d’une taille supérieure ou égale à environ 200 kDa. Pour l’heure, toutefois, la question importante qui reste non résolue est celle de savoir si les méthodes s'appliquent également à l’analyse à haute résolution de complexes protéiques dynamiques plus petits, comme ceux impliqués dans le métabolisme cellulaire. Ici, nous présentons des structures d’une résolution de 3.8 Å, dévoilées par cryo-EM comme la citrate déshydrogénase, cible thérapeutique dans certains cancers (93 kDa), et identifions la nature des changements conformationnels induits par la liaison l’inhibiteur allostérique de molécules de petite taille ML309. Nous rapportons également des structures d’une résolution de 2.8 Å et de 1.8 Å de lactate déshydrogénase (145 kDa) et de glutamate déshydrogénase (334 kDa), respectivement. Avec ces résultats, deux obstacles existants sont franchis : (1) la barre d’une résolution de 2 Å et (2) la mise en évidence de structures protéiques de dimensions inférieures à 100 kDa, démontrant ce faisant que la cryo-EM peut être utile à l’investigation d’une large gamme d’interactions médicament-récepteur et de dynamiques conformationnelles. Alan Merk et al, dans Cell, publication en ligne en avant-première, 26 mai 2016Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
