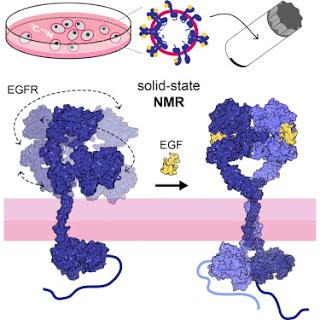
Une approche par RMN montre comment se meuvent les récepteurs dans les membranes natives à haute résolution, montrant que si le domaine intracellulaire de l’EGFR est rigide, le domaine extracellulaire, est, au contraire, hautement dynamique, jusqu’à que s’opère une liaison par un ligand.
Le Récepteur de l’EGF (Facteur de Croissance de l’Epiderme – ou Epidermal Growth Factor dans le texte) ou EGFR représente l’une des protéines-cibles les plus communes dans la thérapie anticancéreuse. Afin d’examiner les propriétés structurelles et dynamiques de l’activation de l’EGFR par l’EGF dans les membranes natives, nous avons développé une approche de résonance magnétique nucléaire du solide (RMNs) soutenue par une polarisation dynamique nucléaire (PDN). Contrairement à d’autres résultats obtenus en cristallographie, nos expériences montrent que le domaine extracellulaire (DEC) libre de tout ligand est hautement dynamique, alors que le domaine kinase intracellulaire (DK) est rigide. La liaison à un ligand restreint la mobilité globale et locale des domaines EGFR, DEC et région C-terminale inclus. Nous proposons que la réduction en entropie conformationnelle du DEC par la liaison à un ligand favorise la liaison coopérative requise pour la dimérisation du récepteur, causant l’activation allostérique de la tyrosine kinase intracellulaire. Mohammed Kaplan, et al, dans Cell, publication en ligne en avant-première, 10 novembre 2016Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
