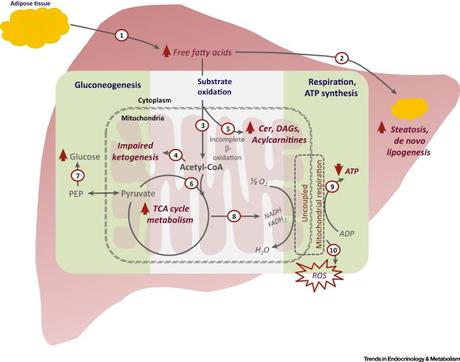
Voies métaboliques et migrations intracellulaires (Cycle de Krebs, cétogénèse, fonction des acylcarnitines permettant aux acides gras de franchir les membranes mitochondriales...) modifiées ou altérées lors d'un dysfonctionnement oxydatif mitochondrial survenant lors d'une stéatohépatite non alcoolique. On remarquera qu'à la fois tissu adipeux et foie sont impliqués.
La stéatohépatite non alcoolique est prévalente (NASH) chez les patients atteints d’obésité ou de diabète de type 2. La stéatohépatite non alcoolique qui comprend la stéatose avec inflammation, lésion hépatocytaire, et fibrose, prédispose à la cirrhose, au carcinome hépatocellulaire et même aux maladies cardiovasculaires. Chez les modèles de rongeurs de laboratoires et chez les humains atteints de NASH, la mauvaise adaptation du flux oxydatif mitochondrial est une caractéristique centrale, de la simple stéatose à la transition NASH. L’induction du cycle de l’acide tricarboxylique (Cycle de Krebs) reflète étroitement la sévérité du stress oxydatif et l’inflammation dans la NASH. La génération de dérivés réactifs de l’oxygène et l’inflammation sont menés par une régulation positive due à un flux oxydatif et à l’accumulation d’intermédiaires lipotoxiques. Des traitements efficaces pour la NASH (perte de poids seule ou avec traitement aux incrétines ou au pioglitazone) sont de nature à atténuer le flux oxydatif mitochondrial et stopper la lésion hépatocytaire. Des médicaments ciblant l’altération de la dysfonction mitochondriale pourrait fournir une stratégie nouvelle de traitement de la NASH. Nishanth E. Sunny, Fernado Brill, Kenneth Cusi, et al, dans Trends in Endocrinology & Metabolism, publication en ligne en avant-première, 13 décembre 2016Source iconographique, légendaire et rédactionnelle: Science Direct / Traduction et adaptation : NZ
