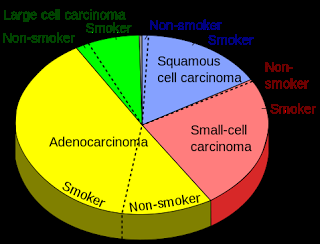
Types de cancers du poumon et fréquence d'occurrence.
Adenocarcinoma = Adénocarcinome
Smoker = Fumeur
Non-smoker = Non-fumeur
Small-cell carcinoma = Carcinome à petites cellules
Squamous cell carcinoma = Carcinome à cellules squameuses
Large cell carcinoma = Carcinome à grandes cellules
Source iconographique: https://commons.wikimedia.org/wiki/File:Pie_chart_of_lung_cancers.svg
J-ALEX était un essai randomisé, ouvert, de phase 3, pour lequel ont été recrutés des patients atteints de cancer du poumon non à petites cellules ALK-positif, naïfs de traitement aux inhibiteurs de l’ALK, naïfs de toute chimiothérapie ou qui avaient reçu une chimiothérapie au préalable, dans 41 sites d’études situés au Japon. Les patients étaient répartis de manière aléatoire (1:1) à l’aide d’un système de réponse interactive par internet utilisant la méthode de blocs permutés et stratifiée selon l’index de performance ECOG (Eastern Cooperative Oncology Group), selon la ligne de traitement, et selon le stade de la maladie pour recevoir l’alectinib 300 mg per os deux fois par jour ou le crizotinib 250 mg deux fois par jour jusqu’à progression de la maladie, toxicité inacceptable, ou retrait de l’étude. Le critère principal était la survie sans progression évaluée par un centre d’examen indépendant. L’analyse d’efficacité a été effectuée sur la population en intention de traiter, et les analyses d’innocuité ont été effectuées chez tous les patients qui avaient reçu au moins une dose du médicament à l’étude. L’étude est toujours en cours, et le recrutement des patients est clos.
Entre le 18 novembre 2013, et le 4 août 2015, 207 patients ont été recrutés et assignés au groupe alectinib (n=103) ou crizotinib (n=104). A la fermeture de la base de données en vue de la deuxième analyse intermédiaire, 24 patients du groupe alectinib avaient interrompu leur traitement en comparaison des 61 patients ayant fait de même dans le groupe crizotinib, cela étant essentiellement dû à un manque d’efficacité ou à des événements indésirables. À la deuxième analyse intermédiaire (date de fermeture de la base des données : 3 décembre 2015), un Comité indépendant de contrôle des données a statué que le critère principal d’efficacité de l’étude avait été atteint (hazard ratio 0.34 [Intervalle de Confiance -IC- 99.7% 0.17-0.71], valeur de p du test logarithmique par rangs <0.0001) et recommandé une publication immédiate des données. La médiane de survie n’avait pas été atteinte avec l’alectinib (IC 95% 20.3-non estimé) et était de 10.2 mois (8.2-12.0) avec le crizotinib. Les événements indésirables de grade 3 ou de grade 4 sont survenus à une fréquence plus importante sous crizotinib (54 [52%] sur 104) que sous alectinib (27 [26%] sur 103). Les interruptions de traitement du fait d’événements indésirables étaient également plus fréquentes sous crizotinib (77 [74%] sur 104) que sous alectinib (30 [29%] sur 103), et un nombre plus important de patients recevant le crizotinib (21 [20%]) que l’alectinib (neuf [9%]) ont interrompu la prise du médicament à l’étude du fait d’événements indésirables graves. Aucun événement indésirable résultant en un décès n’est survenu, quel que soit le groupe de traitement.
Ces résultats fournissent la première comparaison directe entre alectinib et crizotinib et ont ainsi le potentiel de faire changer la norme des soins en vigueur pour le traitement en première ligne du cancer du poumon non à petites cellules ALK-positif. La dose d’alectinib (300 mg deux fois par jour) utilisée dans cette étude est plus basse que les doses approuvées ailleurs qu’au Japon ; cependant, cette limitation est remise en question dans l’étude ALEX toujours en cours. Toyoaki Hida, MD, et al, dans The Lancet, publication en ligne en avant-première, 10 mai 2017
*SNC: système nerveux central
Financement : Chugai Pharmaceutical Co, Ltd.
Source: The Lancet Online / Traduction et adaptation: NZ
