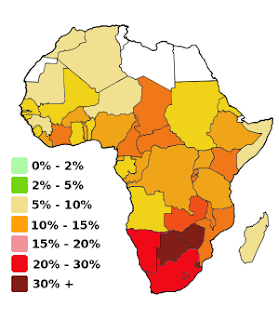
Pourcentage de la population adulte (15-49 ans) atteinte par le VIH/SIDA (2004)
L'Afrique reste le continent où la prévalence de la maladie est la plus élevée.
Source iconographique: https://en.wikipedia.org/wiki/File:Africa_HIV-AIDS-colorscheme2_300px.png
Nous avons réalisé en essai de phase 3b ouvert, à simple bras, multicentrique, dans 26 centres de soins ambulatoires situés en Autriche, France, Allemagne et aux États-Unis d’Amérique. Les participants étaient des adultes infectés par le VIH-1, atteints d’une maladie rénale en phase terminale (clairance de la créatinine < 15 mL/min), placé sous hémodialyse chronique depuis au moins 6 mois précédant la sélection. Une suppression virologique (c’est-à-dire un contenu en ARN de VIH-1 < 50 copies par mL) sous régime antirétroviral stable devait être réalisée depuis les 6 derniers mois au moins précédant la sélection, conditionnée par un comptage CD4 d’au moins 200 cellules par μL. Tous les participants sont passés au traitement coformulé, composé d’elvitegravir 150 mg, cobicistat 150 mg, emtricitabine 200 mg, et tenofovir alafenamide 10 mg une fois par jour, pris après l’hémodialyse sur une durée de 96 semaines au maximum. Nous avons effectué des évaluations aux visites d’étude aux semaines 2, 4, 8, 12, 24, 36, et 48, et toutes les 12 semaines par la suite, sur une période de temps n’excédant pas 96 semaines. Le critère principal était l’incidence des événements indésirables de grade 3 ou plus, survenant au cours du traitement, jusqu’à la semaine 48. Tous les participants qui avaient reçu au moins une dose du médicament à l’étude étaient inclus dans l’analyse principale. Le recrutement de patients est désormais clos pour cette étude.
Entre le 1er février et le 3 novembre 2016, 55 participants ont été recruté et ont reçu au moins une dose du médicament à l’étude. Sur la période d’étude s’étendant jusqu’à la semaine 48, 18 participants sur 55 (33%, Intervalle de Confiance [IC] 95% 20-45) ont présenté un événement indésirable grave de grade 3 ou plus au cours du traitement. Les événements indésirables de grade 3 ou plus, survenant au cours du traitement et relevés chez plus d’un participant incluaient anémie, ostéomyélite, intervalle QT de l’électrocardiogramme prolongé, surcharge liquidienne, hyperkaliémie, hypertension, et hypotension (pour chacun de ces événements, nombre de cas=2). Aucun événement de grade 3 ou plus n’était attribuable au traitement. Trois participants (5%, IC 95% 0-11) ont interrompu la prise de traitement du fait d’événements indésirables ; l’un d’entre eux (prurit allergique de grade 1) était considéré comme lié au traitement. Des événements indésirables liés au traitement ont été rapportés chez six sujets (11%, IC 95% 3-19), le plus commun d’entre eux étant nausée (chez quatre sujets [7%]) ; tous les événements indésirables liés au traitement étaient de grade 1 ou de grade 2 en gravité.
À 48 semaines, le passage à un comprimé unique contenant elvitegravir, cobicistat, emtricitabine, et tenofovir alafenamide était bien toléré. Ce régime de traitement pourrait représenter une option pratique et tolérable permettant de poursuivre le traitement contre une infection au VIH-1 chez des adultes atteints d’une maladie rénale à un stade terminal, placés sous hémodialyse chronique. Prof Joseph J Eron Jr, MD, et al, dans The Lancet HIV, publication en ligne an avant-première, 14 décembre 2018,
Financement : Gilead Sciences
Source : The Lancet Online / Traduction et adaptation : NZ
