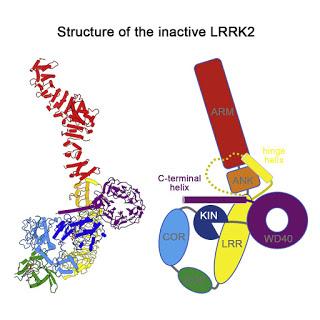
Structure de la protéine LRRK2 inactive
ARM, ANK, LRR, ROC, COR, KIN, WD40 sont les domaines constituant la protéine LRRK2
Des mutations de la kinase à séquence répétée riche en leucine 2 (LRRK2) sont couramment impliquées dans la pathogenèse de la maladie de Parkinson (MP) familiale et sporadique. La protéine LRRK2 régule les processus cellulaires critiques au niveau des organites membraneuses et forme des filaments pathogènes à base de microtubules, mais la base moléculaire sous-jacente à ces rôles biologiques de la protéine LRRK2 reste largement énigmatique. Ici, nous avons déterminé les structures à haute résolution de la protéine LRRK2 humaine pleine longueur, révélant son architecture et les éléments clés d'échafaudage interdomaine pour rationaliser les mutations causant la maladie. Le domaine kinase de la protéine LRRK2 est capturé dans un état inactif, une conformation également adoptée par la mutation associée à la forme la plus courante de la MP, la mutation LRRK2G2019S. Cette conformation sert de cadre pour la conception guidée par la structure d'inhibiteurs spécifiques à la conformation. Nous avons en outre déterminé la structure des dimères de la protéine LRRK2 contrôlée par le domaine COR de LRRK2 et constaté que des mutations ponctuelles à l'interface dimère abolissaient la filamentation pathogène dans les cellules. Dans l'ensemble, notre étude fournit des informations mécanistiques sur les rôles physiologiques et pathologiques de la protéine LRRK2 et établit un modèle structurel pour une future intervention thérapeutique dans la MP. Alexander Myasnikov, et al, dans Cell, publication en ligne en avant-première, 8 juin 2021
Source iconographique, légendaire et rédactionnelle : Science Direct / Préparation post : NZ
