Quels progrès en matière de réparation et régénération cardiaques après un infarctus du myocarde ? Cette revue de la littérature, menée à Université de l'Alabama à Birmingham et publiée dans le Journal of the American College of Cardiology, nous propose un état des lieux actualisé de la recherche fondamentale et translationnelle sur les dernières techniques de réparation des lésions cardiaques, visant à prévenir l'insuffisance cardiaque qui suit souvent une crise cardiaque.
Il y a 20 ans, rappellent les auteurs, des chirurgiens tentaient, pour la première fois de régénérer un cœur humain défaillant par thérapie cellulaire, en injectant des myoblastes musculaires dans le cœur lors d'une opération de pontage. Depuis, les résultats de cette approche se sont révélés neutres ou marginalement positifs. Cependant, l'espoir de thérapies cardiaques régénératives efficaces demeure, concluent ces 9 experts à l’issue de leur méta-analyse.
Quel est le défi : la crise cardiaque tue un grand nombre de cellules du muscle cardiaque, entraînant une cicatrice qui affaiblit le cœur, ce qui entraine, fréquemment, une insuffisance cardiaque. L’absence de réparation musculaire est liée à la capacité très limitée des cellules du muscle cardiaque des mammifères à proliférer ou à se régénérer, sauf pendant une brève période qui suit la naissance.
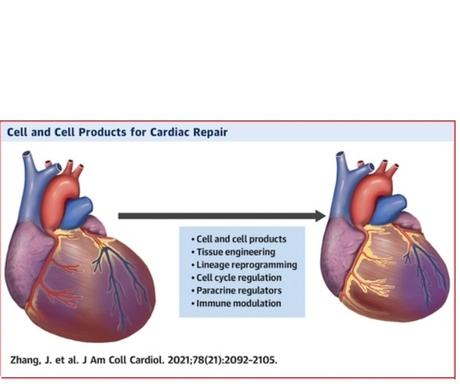
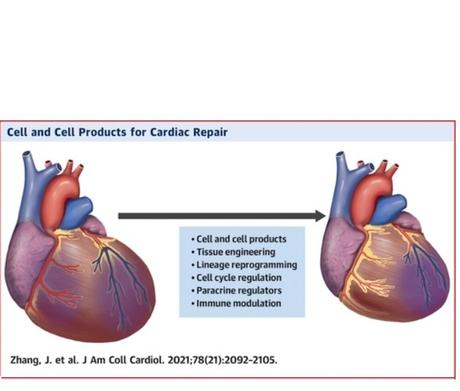
Les grandes avancées en thérapie cellulaire
L’analyse se concentre ici sur 3 points :
- les résultats intrigants ou nouveaux d’essais cliniques récents ;
- l’utilisation de produits dérivés des cellules comme les exosomes plutôt que des cellules musculaires elles-mêmes ;
- les recherches vivant à remplacer une cicatrice myocardique par des cellules du muscle cardiaque en « remontant le temps » ou rajeunissant les cardiomyocytes existants, plutôt qu’en injectant des cellules exogènes.
Vers une thérapie cellulaire intraveineuse et répétée : l'un des essais cliniques examinés a consisté à administrer des cellules cardiaques à des patients atteints de dystrophie musculaire ou myopathie de Duchenne, une maladie qui affecte à la fois les muscles cardiaques et squelettiques. Les cellules administrées ici, dites dérivées des cardiosphères sont un type de cellules stromales/progénitrices cardiaques qui ont une puissante activité immunomodulatrice, antifibrotique et régénératrice à la fois dans les cœurs malades et les muscles squelettiques.
L'essai nommé « HOPE-2 » a donc testé l’administration par intraveineuses répétées de cellules dérivées des cardiosphères à des patients atteints de myopathie de Duchenne avancée, dont la plupart ne pouvaient plus marcher. Les résultats préliminaires de l’essai montrent la sécurité, ainsi que des améliorations majeures des paramètres cardiaques tels que la fraction d'éjection du ventricule gauche et la taille réduite du ventricule gauche.
HOPE-2 est ainsi le premier essai clinique à évaluer la thérapie cellulaire délivrée via un schéma posologique répété, pour toute indication cardiaque, et à évaluer l'administration intraveineuse de cellules dérivées des cardiosphères. Selon les chercheurs, ses conclusions pourraient inciter à l'abandon de l'administration cellulaire invasive à ciblage cardiaque et au passage à l’administration cellulaire intraveineuse et répétée.
Vers l’utilisation de produits dérivés de cellules, vésicules ou exosomes : plusieurs recherches ont suggéré que les cellules transplantées dans le cœur ne survivent pas en quantités importantes cependant les cellules greffées semblent apporter certains avantages fonctionnels dans les performances cardiaques. Les scientifiques ont donc fait l'hypothèse que les cellules n'agissent pas comme une thérapie de remplacement mais plutôt comme des boosters de voies de réparation endogènes grâce à la libération d'un large éventail de biomolécules dotées de capacités de réparation tissulaire.
Cela a conduit les scientifiques à étudier l'utilisation de produits dérivés de cellules plutôt que la transplantation de cellules. La plupart de ces biomolécules (protéines et acides nucléiques non codants) sont enfermées dans de minuscules vésicules que les cellules libèrent naturellement. Lorsque les vésicules, y compris les exosomes, fusionnent dans les cellules réceptrices, les biomolécules peuvent moduler les voies de signalisation. La piste des vésicules ou des exosomes constitue donc processus de fabrication plus simple par rapport à l’utilisation de cellules vivantes, avec de plus, la possibilité de réguler leur puissance et de les conserver par le froid.
L’approche alternative des cellules souches injectées : des recherches ont en effet montré que les cellules souches peuvent favoriser la réparation cardiaque par la libération de molécules biologiquement actives, distinctes des vésicules ou des exosomes.
Booster la prolifération des cellules cardiaques endogènes : la génération endogène de cardiomyocytes ou la possibilité de forcer les cardiomyocytes natifs existants à se diviser, ou d'autres cellules à devenir des cardiomyocytes, constitue une autre voie prometteuse. Une étude préclinique menée sur un gros modèle animal, chez qui une crise cardiaque expérimentale est causée 28 jours après la naissance, montre que l’animal qui a subi une résection tout de suite (1 jour) après la naissance, puis une crise cardiaque expérimentale au jour 28 aboutit à une réparation cardiaque au jour 56 (absence d'infarctus).
L’étude montre ainsi que les cellules du muscle cardiaque chez les grands mammifères peuvent être induites à proliférer et à se régénérer en utilisant une lésion cardiaque au jour 1 et en prolongeant cette fenêtre de réparation néonatale pour remusculariser le muscle cardiaque. En d’autres termes, il s’agirait de réactiver le cycle cellulaire des cardiomyocytes tel qu’il l’est chez le nouveau-né ou du moins, les mêmes voies de signalisation.
La programmation directe de fibroblastes cardiaques à partir de cardiomyocytes est une alternative possible à la génération endogène décrite précédemment : cette piste suppose l’utilisation de miARN et de facteurs supplémentaires ainsi que l'induction de la prolifération des cardiomyocytes – ce qui accessoirement va favoriser la croissance des vaisseaux sanguins cardiaques, soulignent les auteurs.
En conclusion, les chercheurs « parient » ici plutôt sur l’utilisation de cellules dérivées des cardiosphères ou des produits cellulaires avec une perspective supplémentaire, celle de pouvoir un jour remonter le temps « du cycle cellulaire des cardiomyocytes ».
Source: Journal of the American College of Cardiology 23-Nov-2021 Basic and translational research in cardiac repair and regeneration
Lire aussi :
- CRISE CARDIAQUE : Les promesses des thérapies cellulaires exosomales
- CRISE CARDIAQUE : Les exosomes, une option acellulaire et efficace ?
- INSUFFISANCE CARDIAQUE : Les cellules souches font le job ensemble

