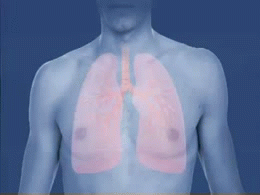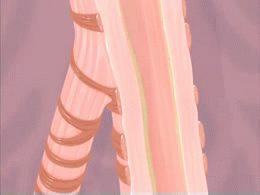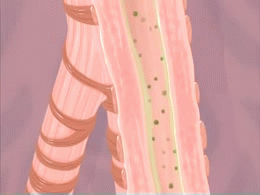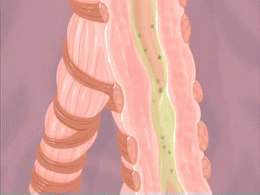
Crise d'asthme. L'animation du phénomène de constriction des voies respiratoires (bronchioles) survenant lors d'une crise d'asthme est montré sur cette animation. Les produits irritants pénétrant dans les poumons ainsi que la formation de mucus qui en résulte sont aussi montrés.
Source iconographique et légendaire: https://fr.wikipedia.org/wiki/Asthme
Le tezepelumab est un anticorps monoclonal humain qui bloque l'activité de la lymphopoïétine stromale thymique. SOURCE a évalué l'effet d'épargne des corticostéroïdes oraux du tezepelumab chez les adultes souffrant d'asthme dépendant des corticostéroïdes oraux.
Nous avons mené cette étude de phase 3, multicentrique, randomisée, en double aveugle, contrôlée par placebo sur 60 sites situés dans sept pays. Les participants âgés de 18 à 80 ans souffrant d'asthme diagnostiqué par un médecin, qui avaient reçu des corticostéroïdes inhalés à dose moyenne ou élevée et qui avaient eu au moins une exacerbation de l'asthme au cours des 12 mois précédant le dépistage étaient éligibles. Les patients qui recevaient des corticostéroïdes inhalés à dose moyenne devaient avoir eu nécessité de voir leur dose augmentée à une dose élevée pendant au moins 3 mois avant le dépistage. Après une phase d'optimisation des corticostéroïdes oraux pouvant aller jusqu'à 8 semaines, les participants ont été répartis au hasard selon une séquence de randomisation en blocs fixes générée par ordinateur pour recevoir du tezepelumab 210 mg ou un placebo par voie sous-cutanée toutes les 4 semaines pendant une période de traitement de 48 semaines (phase d'induction de 4 semaines, phase de réduction des corticostéroïdes oraux de 36 semaines, et phase d'entretien de 8 semaines). La randomisation a été stratifiée par région. Les participants, les enquêteurs et le personnel du site ont été masqués pour l'attribution du traitement. Le critère d'évaluation principal était le pourcentage de réduction catégorisé par rapport au départ de la dose quotidienne de corticostéroïdes oraux à la semaine 48 sans perte de contrôle de l'asthme. Les paramètres d'efficacité et d'innocuité ont été évalués chez tous les participants ayant reçu au moins une dose du médicament à l'étude. (…).
Entre le 5 mars 2018 et le 27 septembre 2019, 150 participants ont été répartis au hasard pour recevoir 210 mg de tezepelumab (n=74) ou un placebo (n=76). Les probabilités cumulées d'atteindre une catégorie de réduction supérieure en pourcentage d'une dose de corticostéroïde oral pour l'entretien quotidien à la semaine 48 étaient similaires avec le tezepelumab ou le placebo dans la population globale (rapport de cotes [OR] 1,28 [Intervalle de Confiance [IC] 95 % 0,69–2,35], p=0·43 ; le critère d'évaluation principal n'a pas été atteint). Les cotes cumulatives étaient plus élevées avec le tezepelumab qu'avec le placebo chez les participants dont le nombre initial d'éosinophiles sanguins était d'au moins 150 cellules par μL (2,58 [1,16–5,75]), mais pas chez les participants dont le nombre d'éosinophiles était inférieur à 150 cellules par μL (0,40 [0,14–1,13]). Le tezepelumab a été bien toléré et aucun problème d'innocuité n'a été identifié. 53 (72 %) des 74 participants assignés au tezepelumab et 65 (86 %) des 76 participants assignés au placebo ont signalé un événement indésirable. Des événements indésirables graves ont été signalés chez 12 (16 %) participants du groupe tezepelumab et 16 (21 %) participants du groupe placebo.
Nous n'avons pas observé d'amélioration significative de la réduction de la dose de corticostéroïdes oraux avec le tezepelumab par rapport au placebo dans la population globale de cette étude d'épargne des corticostéroïdes oraux, bien qu'une amélioration ait été observée chez les participants dont le nombre initial d'éosinophiles sanguins était d'au moins 150 cellules par μL.Michael E Wechsler, MD, et al, dans The Lancet Respiratory Medicine, publication en ligne en avant-première, 29 mars 2022
Financement : Astra Zeneca et Amgen
Source : The Lancet Online / Préparation post : NZ
