
Hubert Reeves l'astrophysicien tient cette anecdote des " chevaux pris dans la glace " pour véridique dans son livre " L'Heure de s'enivrer " (1986).
Extrait du roman " Kaputt " de Curzio Malaparte :
" Fous de terreur, les chevaux de l'artillerie soviétique - il y en avait près de mille - se lancèrent dans la fournaise et échappèrent aux flammes et aux mitrailleuses. Beaucoup périrent dans les flammes, mais la plupart parvinrent à atteindre la rive du lac et se jetèrent dans l'eau [...] Le jour suivant, lorsque les premières patrouilles, les cheveux roussis, atteignirent la rive, un spectacle horrible et surprenant se présenta à eux. Le lac ressemblait à une vaste surface de marbre blanc sur laquelle auraient été déposées les têtes de centaines de chevaux ".
En fait on présume que l'eau liquide était très froide dans le lac, protégée sous une très fine pellicule de glace. En passant sur la glace et en la brisant, les chevaux on déclenché le gel brutal de tout le reste du lac, qui les a alors figé sur place, refermant sur eux un piège mortel.
Alors qu'est-ce que la surfusion ?
Version courte en vidéo
Vous pouvez mettre les sous-titres et choisir la traduction automatique en français.
Version longue, parceque vous kiffez
Vous avez tous appris que l'eau gèle à 0°C n'est-ce pas ? Alors disons plutôt qu'elle devrait être à l'état solide à 0°C, donc gelée. Oui elle " devrait "... mais ce n'est pas toujours le cas.
Elle peut rester liquide parfois jusqu'à −39°C ! On appelle ça, en dessous de 0°C, la surfusion.
C'est un état métastable de l'eau, qui reste bloquée en phase liquide, alors qu'elle devrait être en phase solide. Le schéma ci-dessous est une analogie " mécanique " qui ne sert qu'à illustrer ce que veut dire métastable.
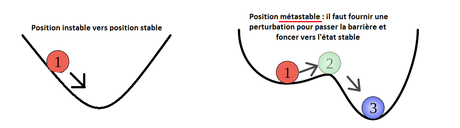
Quand l'eau est liquide, toutes les petites molécules d'eau sont libres de leurs mouvements les unes par rapport aux autres, elles sont agitées (mais restent globalement liées par leur liaisons hydrogène pour former une phase condensée, liquide, sinon ça serait un gaz).
Par contre quand l'eau se solidifie, elle cristallise et les molécules se figent les unes par rapport aux autres (elles continuent de vibrer un peu, elles ne sont pas complètement figées tant qu'on est pas au 0 absolu de température, disons qu'elles ne se recombinent pas et gardent à peu près leurs places les unes par rapport aux autres). Et moins d'agitation = moins d'énergie.
Le processus de solidification (passage dans notre cas de l'eau liquide à l'eau solide) est donc un processus qui libère de l'énergie. Comment ? Il va libérer de la chaleur : on dit que c'est un processus exothermique (du grec ancien ἔξω, éxo " hors de ", et pour " thermique " vous savez déjà)

Eau liquide : molécules d'eau à l'état liquide, reliées par les liaisons hydrogène. La polarité de la molécule d'eau fait que les hydrogènes et oxygènes, de charge opposée (mais non égale) s'attirent (attraction électrostatique).

Par contre pour que le processus démarre, il faut qu'un premier cristal se forme (à un ou plusieurs endroits du liquide). C'est ce qu'on appelle la phase de " nucléation ", qu'on pourrait traduire par la phase de constitution d'un premier noyau de cristal solide, autours duquel tout le reste du liquide va lui même cristalliser de loin en loin.
La " nucléation " c'est la formation spontanée de germes de cristaux. On a refroidit l'eau à 0°C puis en dessous, et plus il fait froid plus les molécules sont calmes. Alors à partir de 0°C, localement dans le liquide, les molécules d'eau qui s'attirent les unes les autres via les liaisons hydrogène sont suffisamment calmes pour se stabiliser et se lier plus fortement et des mini cristaux vont se former (et plus il fait froid plus ce phénomène arrive souvent et à plein d'endroits du liquide).
La cristallisation c'est quand tout se met à geler. Tant qu'on en est pas à cette étape ça s'appelle la nucléation parceque ça forme juste des mini-cristaux qu'on appelle des " germes de cristaux ". Or le problème c'est que ces mini cristaux, sont instables. Ils se forment et puis... hop ils refondent à cause des molécules d'eau agitées autours d'eux.
Ils refondent parce qu'ils sont trop petits. En effet, on vous a expliqué au début que la cristallisation était exothermique, donc qu'elle libérait de l'énergie. Du coup, le volume de mini-cristal qui se forme est tout tranquille, libéré de cette énergie. Par contre à sa surface s'exerce la tension superficielle de l'eau liquide qui l'entoure ! Cette énergie souvent refait fondre le pauvre petit volume.
Tant que les noyaux qui se forment sont petits, leur volume est très petit par rapport leur surface (le volume est de l'ordre du cube - puissance 3, et la surface de l'ordre du carré - puissance 2. Donc le volume augmente beaucoup plus vite que sa surface extérieure).
La phase solide " résiste " à la refonte grâce à son volume (plus il y a de volume de solide tout calme, plus il est difficile à agiter). Par contre il est poussée à refondre depuis sa surface, car c'est à sa surface que s'exerce l'agitation et de la tension de l'eau liquide.
Il faut donc que le rapport entre le volume du germe et sa surface soit assez gros pour qu'il reste solide. Bref, il faut que le germe soit assez gros pour rester stable dans un état solide. Dès que ça arrive, alors c'est la réaction en chaîne et toute l'eau prend en bloc !
Alors pourquoi au bout d'un moment ça finit quand même par cristalliser ? Parce que plus il fait froid, plus des germes se forment souvent et partout, plus statistiquement il va finir par s'en former un assez gros pour démarrer la cristallisation. Mais bien sur, on est pas obligé d'attendre ce moment là, on peut introduire des germes (poussières, cristaux déjà constitués) ou fournir de l'énergie (perturbation) en tapant fort sur la surface de l'eau pour former le premier cristal assez gros pour résister à la refonte.
Bon ceci-dit, avouons que le phénomène n'est pas encore complètement maîtrisé pour être honnête, voici un article intéressant de l'année dernière - 2014 - sur le sujet (qui mentionne les sources dans Nature si vous voulez y voir de plus près).
Et pour ceux qui aiment les équations c'est par ici.

